Содержание.
Иммунная система организма.
Органы иммунной системы.
Клетки ИС.
Молекулы ИС.
Естественный иммунитет.
Система комплемента.
Фагоцитарная реакция.
Иммунный ответ организма.
Антигены, антитела.
Гуморальный и клеточный типы иммунного ответа.
Антигены.
Состояние иммунной системы организма.
Антитела.
Иммунологическая толерантность.
Противоинфекционный иммунитет и его формы.
Иммунопрофилактика и иммунотерапия.
Экологическая иммунология.
Клиническая иммунология.
Иммунодефицитные состояния.
Аутоиммунные заболевания.
Иммунный статус организма.
Иммунокорригирующая терапия
Аллергии.
Аллергены.
Аллергическая реакция.
Типы аллергических реакций.
Регуляция иммунного ответа.
Физиологическая регуляция.
Генетическая регуляция.
Система HLA.
Трансплантационный иммунитет
Иммунология.
Направления иммунологии:
- инфекционная учение об антителах (Ат) - учение о фагоцитах учение о системе комплемента
- неинфекционная иммунология ( иммунопатологии, аллергии, трансплантационный иммунитет, учение о толерантности)
- клиническая иммунология
- экологическая иммунология
Иммунная система организма.
Иммунная система организма (ИС) - совокупность лимфоидных органов и тканей, которые определяют контроль за антигенным постоянством внутренней среды организма.
Органы: красный костный мозг, тимус, селезенка, лимфоузлы и лимфатические образования кишечника и других органов.
Клетки: В- и Т- лимфоциты, моноциты, макрофаги, нейтро-, базо-, эозинофилы, тучные, эпителиальные клетки, фибробласты.
Биомолекулы: иммуноглобулины, моно- и цитокины, антигены, рецепторы и др.
Органы иммунной системы.
Органы ИС разделяют на центральные и периферические. К центральным относят:
- красный костный мозг (medulla ossea rubra); его главная функция - продукция иммунокомпетентных клеток из стволовой полипотентной; все лимфоидные клетки имеют на своей поверхности гликопротеиновые маркеры - т. н. кластеры дифференцировки - CD (cluster of differentiation); стволовая клетка - предшественница клеток лимфоидного и миелоидного рядов имеет маркер CD34+.
- вилочковая железа (thymus) - место созревания и дифференцировки Т- лимфоцитов (их общий маркер - CD3+), затем заселяющих периферические органы иммунитета; в тимусе происходит селекция Т- лимфоцитов, имеющих рецепторы к собственным тканям; чем более длительно функционирует тимус, тем дольше живет организм; наиболее развита железа в детском возрасте, ее инволюция начинается примерно в 12 - 14 лет. К периферическим органам ИС относят селезенку, лимфатические узлы и образования, миндалины, в которых есть т. н. Т- и В- зоны, в которых созревают соответственно Т- и В- лимфоциты.
Клетки ИС
Т- лимфоциты - самая многочисленная (60%) популяция клеток ИС, которая в свою очередь разделяется на субпопуляции. Хелперы и супрессоры являются иммунорегуляторными клетками, а киллеры и эффекторы ГЗТ - эффекторными. Т- киллеры разрушают инфицированные клетки и клетки опухолей. Существует еще субпопуляция т.н. естественных киллеров (ЕК), они имеют CD56/57+. Это большие гранулярные клетки, в гранулах содержится белок перфорин, который может проникать в мембрану клетки-мишени и в результате полимеризации образовывать мембраноатакующий комплекс (своеобразная ''дырка'' в мембране), вызывая осмотический ''взрыв'' и лизис клетки.
В- лимфоциты (15-20%) являются более гомогенной популяцией, отвечают за развитие гуморального иммунитета. Стимулированные В- лимфоциты называют плазмацитами, они вырабатывают иммуноглобулины.
Моноциты (CD16+) - являются предшественниками тканевых макрофагов. Стадии дифференцировки: монобласт R промоноцит R моноцит крови R тканевой макрофаг.
Макрофаги - перитонеальные, легочные, купферовские клетки, клетки Лангерганса, мезангиальные клетки почек, остеокласты, клетки микроглии и др. - своеобразные ''мусорщики'', участвуют в формировании фагоцитарной реакции, гуморального иммунитета, одна из важнейших функций - ''презентация'' антигенов (см. далее). Эти типы клеток (1 - 4) являются иммунокомпетентными.
Нейтрофилы, базофилы и эозинофилы - играют определенную роль в фагоцитозе условно-патогенных бактерий, развитии аллергий. Активированной формой базофилов являются т.н. тучные клетки (mast cells) - их еще называют тканевыми базофилами. Они принимают участие в иммунном ответе аллергического характера.
Фибробласты и эпителиальные клетки - являются микроокружением лимфоидных органов, участвуют в локализации микроорганизмов и воспалительных процессов (образование гранулем), вырабатывают фибробластный интерферон.
Молекулы ИС.
Антигены (Аг) - химические вещества, свободные либо встроенные в мембрану клетки, способные индуцировать иммунный ответ (ИО). Мембранные Аг делятся на дифференцировочные (CD-Аг), HLA ((human leukocyte antigen), относятся к главному комплексу гистосовместимости (ГКГС или MHC - main histocompartibility complex), их три класса), детерминантные.
Рецепторы являются анализаторами внешней среды, их 102 - 105 на поверхности клетки, они необходимы для контактов ''клетка-молекула'' и бывают Аг- специфическими, для цитокинов, для гормонов.
Белки системы комплемента - С1-С9 (см. далее).
Иммуноглобулины (5 классов)
Цито- и монокины - низкомолекулярные гормоноподобные биомолекулы, продуцируемые активированными иммунокомпетентными клетками, являются регуляторами межклеточных взаимодействий, их несколько групп - интерлейкины (около 12), факторы роста (эпидермальный, фактор роста нервов), колониестимулирующие (лимфопоэтины), хемотаксические факторы, фактор некроза опухолей.
Интерфероны - также являются регуляторами межклеточных взаимодействий, их известно три - a , b , g . Иммунная система работает строго организованно, ее работа сопряжена и согласована с работой других систем. Работа ИС специфична и конкретна, с другой стороны, она универсальна и очень разнообразна по своим функциям. ИС характеризуется памятью.
Естественный иммунитет.
Естественный иммунитет может определяться неспецифическими и специфическими механизмами и факторами. Неспецифический иммунитет - совокупность защитных факторов, направленных на элиминацию широкого круга патогенов. Эти факторы являются универсальными, детерминируются многими генами, передаются по наследству, являются видовыми (человек не болеет чумой плотоядных). К факторам естественного иммунитета относят: неиммунные - барьеры (кожа, слизистая), секрет потовых, сальных, слюнных желез (содержит разнообразные бактерицидные вещества), желез желудка (соляная кислота и протеолитические ферменты), нормальная микрофлора (антагонисты патогенных микроорганизмов). иммунные гуморальные (система комплемента, лизоцим, b -лизин, трансферрин и др.) клеточные (фагоцитарная реакция, работа ЕК)
Система комплемента.
Система комплемента - это совокупность белков сыворотки крови, циркулирующих в неактивном состоянии. Большинство из них являются протеазами. При попадании (или образовании) в ткани (кровь) активаторов (структуры Г+ или Г- бактерий, иммунные комплексы) происходит активация системы - каскадное взаимодействие белков системы комплемента с образованием промежуточных продуктов, с образованием повреждений в мембране клеток-мишеней, нейтрализацией вирусов. В систему входит более 25 белков, из которых девять - комплементные белки (С1 -С9), а остальные -факторы (B, D, P, H и др.). При активации происходит расщепление молекул комплементных белков на фрагменты a (меньший) и b (больший). Меньший фрагмент, как правило, активный. Многие фрагменты обладают ферментативными свойствами (их обозначают сверху линией - С1), могут являться ингибиторами, активаторами и медиаторами различных процессов. Центральное место в системе комплемента занимает белок С3. При отсутствии каких либо активаторов происходит его медленный распад: С3 R С3a + C3b. Фрагмент C3b фиксируется на поверхности микроорганизма При появлении какого - либо активатора распад С3 происходит значительно быстрее благодаря запуску систем активации комплемента по классическому или альтернативному путям. Активаторами альтернативного пути являются, как правило, компоненты микроорганизмов, факторы В, D и пропердин также являются необходимыми участниками. Система активации обладает положительной обратной связью. В норме в крови постоянно циркулирует некоторое количество С3b, и В. Эти белки комплементарные друг- другу и соединяются в комплекс С3bB, от которого под влиянием фактора D отщепляется фрагмент Ва, т.о. образуется комплекс С3bBb, который катализирует распад С3 на фрагменты. Пропердин удлиняет жизнь этого комплекса. В случае длительного инфекционного процесса к инфекционному агенту образуются антитела и комплекс ''агент ћ антитело'' (иммунный комплекс) является активатором системы комплемента по классическому пути. В норме в крови циркулирует фрагмент белка С1 - С1qrs, который под влиянием иммунного комплекса становится активным (С1qrs). Этот фрагмент катализирует расщепление С4 на С4а и С4b. Фрагмент С4b соединяется с белком С2, образовавшийся комплекс С4b2 становится субстратом для С1qrs, от него отщепляется фрагмент C2b, а образовавшийся комплекс C4b2a катализирует распад С3 на фрагменты.
Последовательность событий, происходящих после расщепления С3.
Задача данного этапа - формирование мембраноатакующего комплекса (МАК), который состоит из белков С5 - С9 и на 80-90% похож на перфорин. К фиксированному на мембране клетки фрагменту С3b присоединяется белок С5. От образовавшегося комплекса С3b5 под воздействием С3bBb отщепляется С5а, а к С3b5b последовательно присоединяются белки С6, С7, С8. Кульминацией данного процесса является присоединение С9, после чего происходит изменение конформации всего комплекса и образуется воронкообразное отверстие в мембране, в результате наступает лизис клетки. В результате работы этой системы высвобождаются вещества, которые являются анафилотоксинами (вещества, которые вызывают высвобождение гистамина из базофилов и тучных клеток), хемотаксинами (вызывают миграцию клеток в место работы комплемента), модуляторами иммунного ответа (С3а подавляет, а С5а усиливает продукцию антител). Итак, можно подвести итог, перечислив функции системы комплемента:
- лизис клеток;
- растворение иммунных комплексов;
- участие в фагоцитозе;
- участие в воспалительной реакции;
- образование хемотаксинов;
- модуляция иммунного ответа;
- нейтрализация веществ.
Фагоцитарная реакция.
К фагоцитирующим клеткам относят: микрофаги - это полиморфноядерные лейкоциты (нейтро-, базо-, эозинофилы), они эффективны в основном против условно - патогенных микроорганизмов. макрофаги - это мононуклеарные фагоциты (1- 6% в крови). Фагоцитарная реакция - процесс захвата, умерщвления и переваривания инфекционных агентов. Выделяют следующие стадии:
- стадия хемотаксиса (приближение к объекту);
- стадия опсонизации (процесс взаимодействия иммуноглобулинов (IgG1, IgG3, IgM) и белков системы комплемента (C3b, C4, C5a) с инфекционной частицей);
- прикрепление опсонизированной частицы на поверхность фагоцита;
- стадия захвата; образование фагоцитосомы;
- стадия умерщвления и переваривания;
- стадия исхода.
Вещества, участвующие во второй стадии, называют опсонинами. На фагоцитах есть рецепторы к Fc- фрагментам иммуноглобулинов и к белкам системы комплемента. Момент прикрепления опсонизированной частицы к макрофагу вызывает активацию последних. Далее идет захват бактериальной клетки (антигена) и образование фагосомы. Лизосомы сливаются с фагосомами, при этом происходит резкое снижение рН и начинают действовать ферменты внутриклеточной бактерицидности (система миелопероксидаз). Образуются свободные радикалы, свободный кислород, которые быстро убивают бактерии. В зависимости от стадии исхода различают :
- завершенный фагоцитоз - полное разрушение фагоцитированного объекта;
- незавершенный фагоцитоз - микроорганизм разрушается, но остаются его компоненты с антигенной активностью;
- наблюдается персистенция микроорганизма;
- происходит размножение микроорганизма.
Иммунный ответ организма. Антигены, антитела. Гуморальный и клеточный типы иммунного ответа.
Иммунный ответ - это сложная многокомпонентная, кооперативная реакция иммунной системы организма, индуцированная антигеном и направленная на его элиминацию. Явление иммунного ответа лежит в основе иммунитета. Иммунный ответ зависит от:
- антигена - свойства, состав, молекулярная масса, доза, кратность попадания, длительность контакта); - состояния организма (иммунологическая реактивность);
- условий внешней среды.
Антигены. Антигены - химические вещества, свободные, либо входящие в состав клеток, способные индуцировать иммунный ответ организма. Полноценный антиген состоит из двух частей:
- носитель (стабилизирующая часть) - 97 - 99% молекулы антигена; это, как правило, макромолекулы, инертные корпускулярные частицы;
- детерминантная группа (эпитоп) - олигосахариды или олигопептиды, располагаются как правило на поверхности молекулы (эпи-); на одном носителе может быть несколько эпитопов, в связи с этим вводят понятие эпитопная плотность;детерминантная группа определяет специфичность антигена.
Свойства антигенов: способны вызывать иммунный ответ; способны к специфическому взаимодействию с различными молекулами и клетками (эритроцитами и т.д.). Если реализованы оба указанных свойства, то такой антиген называют полноценным, если реализовано только второе свойство, то такой антиген называют неполноценным или гаптеном. Гаптен может быть фиксирован на специальные носители - адьюванты. Механизм действия адьювантов:
- создают депо антигенов;
- укрупняют молекулу;
- активируют лимфоидную ткань.
Классификация антигенов:
по чужеродности : ксеноантигены (гетеро-) - не принадлежат особям данного вида; аллоантигены (гомо-) - принадлежат особям данного вида; аутоантигены - собственные антигены, например ''забарьерные'' клетки - сперматозоиды, клетки мозга; собственные клетки с иммунной активностью;
по типу вызываемого иммунного ответа :
- иммуногены;
- аллергены; толерогены;
- трансплантационные антигены;
по связи с вилочковой железой ( тимусом) : - Т- зависимые; - Т- независимые.
по локализации в микроорганизме :
- О - антигены - липополисахариды (ЛПС) клеточной стенки, термостабильные, высокоактивные, многообразны у разных микроорганизмов и даже у одного и того же;
- Н - антиген - жгутиковый белок, термолабильный, достаточно активный, также разнообразен;
- К - антигены - капсульные гликопротеиды, иммуногенность зависит от химической природы; фимбриальные антигены; протоплазматические антигены; экзоаллергены;
по специфичности для микроорганизма - носителя :
- видовые - у всех особей вида;
- типовые - вариантные, у варов;
- групповые - общие для микроорганизмов разных видов и родов;
- стадийные - появляются на определенных стадиях развития;
- штаммоспецифичные.
Состояние иммунной системы организма.
Иммунный ответ (ИО) развивается в периферических лимфоидных органах. В ИО участвуют макрофаги, Т- и В- лимфоциты, фибробласты, ретикулярные клетки.
Макрофаги. Зрелые макрофаги имеют рецепторы к антигенам (Fc), С3b- рецепторы, антигены гистосовместимости. Макрофаги участвуют как в естественном, так и в специфическом ИО. На ранней стадии ИО макрофаги выполняют функцию презентации антигена - в результате фагоцитоза антиген расщепляется, а его эпитоп выносится на мембрану в комплексе с белком МНСII. На конечной стадии ИО макрофаг активируется лимфокинами.
В- лимфоциты. В- лимфоциты распознают антигены, участвуют в гуморальном ИО, имеют рецепторы к эритроцитам мышей (МЕ - Mice's Erythrocytes), Fc, C3b, к антигенам, к антигенам гистосовместимости. Они не имеют специфических антиген- распознающих рецепторов, разделяются на огромное количество клонов. Антиген- распознающим рецептором является молекула иммуноглобулина.
Т- лимфоциты. Т- лимфоциты разделяют на четыре основных субпопуляции - Т - хелперы, Т - супрессоры, Т- киллеры и Т - эффекторы. Все они имеют рецепторы к эритроцитам барана, к иммуноглобулинам (Fc), к белкам системы комплемента (но не имеют рецепторов к C3b), к интерлейкинам, к антигенам, имеют антигены МНСI и MHCII. Субпопуляции Т- лимфоцитов неоднородны, так, Т- хелперы разделяются на две группы - Т- хелперы 1 и Т- хелперы 2. Т- хелперы 1 являются активаторами КИО, а Т- хелперы 2 - ГИО. Т- лимфоциты обеспечивают клеточный, антивирусный, антибактериальный иммунитет, ГЗТ. В зависимости от путей реализации иммунный ответ разделяют на гуморальный (ГИО) и клеточный (КИО), однако в чистом виде ни один из них не проявляется. Гуморальный иммунный ответ контролируется красным костным мозгом, развивается на растворимые агенты - белки, ЛПС, экзотоксины, на внеклеточных паразитов. Существует два варианта ГИО. Если ответ происходит на Т - независимые антигены, то это т. н. простой ответ, он возможен потому, что некоторые антигены способны сами активировать Т- лимфоциты. В этом случае синтез IgM не сопровождается образованием клеток памяти. В случае, если ответ формируется в ответ на Т- зависимые антигены, происходит кооперация Т- и В- лимфоцитов. Выделяют следующие стадии: 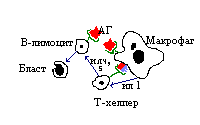
- распознавание антигена;
- презентация антигена - макрофаг поглощает антиген, расщепляет, соединяет с белками МНС I и МНС II и переносит на мембрану;
- передача информации на Т- хелпер;
- бласттрансформация В- лимфоцитов, дифференцировка бластов в плазмациты и В- клетки памати; синтез антител и элиминация антигена. Формирование механизмов синтеза антител называют индуктивным периодом, с момента начала синтеза антител начинается продуктивный период. Функция антител: активация системы комплемента, нейтрализация токсинов, опсонизация антигенов, преципитация мелких антигенов. Иммунный ответ идет в несколько стадий. Сначала идет синтез иммуноглобулинов М. При вторичном попадании антигена процесс протекает быстрее и интенсивнее. Клеточный иммунный ответ развивается на чужеродные клетки, не клетки, пораженные вирусом, на внутриклеточных организмов. Контролируется тимусом, филогенетически более поздний. Основная группа клеток, осуществляющих клеточный иммунный ответ, - Т- лимфоциты. Основные эффекторы - сенсибилизированные Т- лимфоциты или выделяемые ими медиаторы ( лимфокины ). Сенсибилизированный Т- лимфоцит является антигенспецифичным, т. к. стимулирован антигеном. Дифференцировка происходит под воздействием интерлейкина 2.
Клеточный иммунный ответ разделяют на стадии:
- распознавание макрофагом или другой антиген-презентирующей клеткой;
- обработка антигена макрофагом или другой антиген-презентирующей клеткой;
- презентация обработанного антигена в комплексе с белками МНС I и МНС II (Т- киллеры непосредственно взаимодействуют с комплексом АГ* МНС I, а Т- эффекторы - посредством Т-хелперов); передача информации на Т- хелперы; 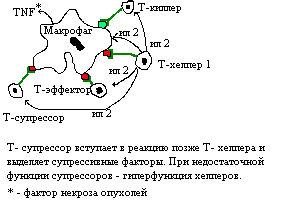
- передача информации на Т- эффекторы;
- пролиферация и дифференцировка Т - эффекторной популяции под действием интерлейкина 2. Т- киллеры при встрече с чужеродной клеткой выделяют перфорин, разрушающий ее мембрану. Т- эффекторы оказывают опосредованное действие: выделяют факторы хемотаксиса, подавления миграции макрофагов и лейкоцитов, активации. Клетки в очаге пролиферации образуют инфильтрат, который окружается фибробластами, продуцируемым ими коллагеном, и становится гранулемой. Гранулема выполняет ограничивающую функцию - локализует процесс воспаления, препятствует его распространению; элиминирующая функция выражена слабо.
Антитела.
Антитела (иммуноглобулины) - продукты гуморального имунного ответа, это глобулины, специфически реагирующие с антигеном, вызвавшим их образование. Это сложные белковые образования, мономеры или полимеры. Молекулы иммуноглобулинов состоят из двух параллельных цепочек: 2H (две ''тяжелые'' цепочки) и 2L (две ''легкие'' цепочки). Существует 5 типов тяжелых цепей - они клоноспецифичны и обозначаются буквами греческого алфавита - d , m , a , d , e , и 2 типа легких цепей - k и l . В одной молекуле иммуноглобулина никогда не может быть два одинаковых типа цепей. Структура иммуноглобулинов. 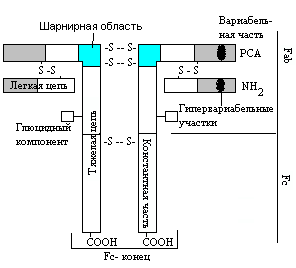 В структуре иммуноглобулина можно выделить: константные области ( > ? H и ? L), в них постоянная последовательность аминокислот; вариабельные части; гипервариабельные участки; шарнирные области - необходимы для изменения конформации, в них есть участки связывания белков системы комплемента. При обработке молекулы иммуноглобулина папаином он распадается на два фрагмента - Fab (Fragment antigen - binding) и Fc. С- концевой участок H- цепей служит для прикрепления к клеточному Fc- рецептору. Fc- фрагмент способен активировать систему комплемента, обеспечивает способность иммуноглобулина G проходить через биомемрану (проходит через фетоплацентарный барьер), определяет цитофильность, оказывает опсонизирующее действие на объекты фагоцитоза. Любой иммуноглобулин имеет как минимум 2 активных центра, а если молекулы объединены в полимер - и более. Иммуноглобулины разделяют на классы, а те, в свою очередь, на подклассы. Класс иммуноглобулина соответствует типу тяжелой цепи - следовательно, существует 5 классов иммуноглобулинов: G (d), M (m), A (a), D (d), E (e).
В структуре иммуноглобулина можно выделить: константные области ( > ? H и ? L), в них постоянная последовательность аминокислот; вариабельные части; гипервариабельные участки; шарнирные области - необходимы для изменения конформации, в них есть участки связывания белков системы комплемента. При обработке молекулы иммуноглобулина папаином он распадается на два фрагмента - Fab (Fragment antigen - binding) и Fc. С- концевой участок H- цепей служит для прикрепления к клеточному Fc- рецептору. Fc- фрагмент способен активировать систему комплемента, обеспечивает способность иммуноглобулина G проходить через биомемрану (проходит через фетоплацентарный барьер), определяет цитофильность, оказывает опсонизирующее действие на объекты фагоцитоза. Любой иммуноглобулин имеет как минимум 2 активных центра, а если молекулы объединены в полимер - и более. Иммуноглобулины разделяют на классы, а те, в свою очередь, на подклассы. Класс иммуноглобулина соответствует типу тяжелой цепи - следовательно, существует 5 классов иммуноглобулинов: G (d), M (m), A (a), D (d), E (e).
| Ig | Субклассы | Время полужизни | Краткая характеристика |
| G | G1, 2, 3, 4 | 18 - 23 дня | около 80% всех Ig, обладает высоким противо-воспалительным действием, тормозит синтез IgМ, проходит через фетоплацентарный барьер |
| M | M1, 2, 3 | 5 - 6,5 дней | около 6% всех Ig, пентамер, обладает высокой биологической активностью, появляется во время первичной иммунной реакции |
| A | A1, 2 | 5 дней | около 13% всех Ig, существует в двух формах - сывороточный (мономер) и секреторный (димер); секреторные (SIgA) защищают слизистые, синтез идет в подслизистой, при выходе на поверхность слизистой к димеру присоединяется ''секреторный'' компонент, защищающий от протеаз |
| D | ----- | 2,8 дня | обнаруживается на поверхности В- лимфоцитов, роль не ясна |
| E | ----- | 2,4 дня | мономер, обладает высокой цитофильностью к базофилам и тучным клеткам, вызывает немедленную гиперсенсибилизацию анафилактического типа |
Многообразие биологических функций иммуноглобулинов определяется Fab и Fc- фрагментами. С Fab- фрагментом связано понятие авидности ( лат.- жадность) антител. С этим свойством связано такое качество, как афинность - прочность комплекса АГ*АТ, зависит от ''валентности'' антител и расположения активных центров. Афинность - сила связывания активного центра антитела с детерминантой антигена. Она определяется их соответствием друг другу. Соответствие создает условия действия сил на малых расстояниях. Антигенные свойства иммуноглобулинов. Антигенные свойства иммуноглобулинов определяются различными антигенными детерминантами, расположенными в белковой части молекулы. Дифференциация иммуноглобулинов на классы и подклассы зависит от различия детерминантных групп в участках тяжелых цепей, такие дерминанты называют изотипическими, а иммуноглобулины одного класса - изотипы. Важное значение имеет явление аллотипии, заключающееся в том, что иммуноглобулины у разных индивидуумов могут различаться по антигенной специфичности из - за генетически детерминированных особенностей строения первичной структуры полипептидных цепей молекул иммуноглобулинов. Явление идиотипии выражается в наличии в молекулах иммуноглобулинов определенных антиген - специфичных последовательностей. Так, иммуноглобулины различных классов могут относиться к одному идиотипу.
Иммунологическая толерантность.
Иммунологическая толерантность - состояние специфической иммунологической ареактивности организма к определенным антигенам. Антигены, которые вызывают иммунологическую толерантность, называются толерогенами. Иммунологическая толерантность характеризуется:
- отсутствием ответа на антиген;
- отсутствием элиминации антигена при повторном его введении;
- отсутствием антител на данный антиген.
Существует два вида иммунологической толерантности:
- естественная - развивается при попадании антигена во внутриутробном периоде. Теория формирования: удаление клеток, которые имеют рецепторы к собственным антигенам, или их блокада избытком антигена. Эта роль выполняется тимусом.
- приобретенная - можно вызвать высокими или очень низкими дозами антигена.
Механизмы иммунологической толерантности:
- супрессорный - Т- супрессор действует на В- лимфоцит;
- Т- супрессор подавляет функции Т- хелперов;
- блокада антиген-связывающих рецепторов;
- клональная делеция.
Противоинфекционный иммунитет и его формы.
Противоинфекционный иммунитет - это приобретенный иммунитет против конкретного возбудителя инфекционного заболевания, индуцированный им и направленный на его элиминацию.
Классификация: по происхождению - естественный. Естественный пассивный - приобретается пассивно, когда антитела от матери во время внутриутробного развития передаются плоду через плаценту. Передаются антитела против возбудителей тех болезней, которыми мать переболела или против которых была иммунизирована. Если ребенок вскармливается грудным молоком, то он получает еще и секреторные иммуноглобулины А. Естественный активный - приобретается в результате перенесенного заболевания. Приобретается индивидуально, его продолжительность различна, проявляется через 1-2 недели после начала заболевания и может оставаться на месяцы, годы, пожизненно. Искусственный: искусственный пассивный - приобретается при введении в организм готовых антител. Возникает сразу, длится 2-3 недели, если гетерологичные антитела (от лошади), и 4-5 недель, если антитела человеческие. Искусственный активный - при введении вакцин. По связи с возбудителем - стерильный (постинфекционный) - сохраняется после элиминации возбудителя из организма (корь, дифтерия). Нестерильный (инфекционный) - существует до тех пор, пока в организме есть возбудитель (туберкулез, сифилис). По охвату организма - общий - охватывает весь организм. местный - какой либо орган. Основная роль принадлежит IgA2. Эти иммуноглобулины связывают антигены, препятствуют адсорбции микробов, блокируя их рецепторы. По механизму - гуморальный клеточный смешанный (основной) По направленности - антитоксический - против экзотоксинов, ферментов - токсинов, эндотоксинов. В основе лежит гуморальный иммунный ответ. Элиминация токсина происходит за счет взаимодействия антител с токсичной группой токсина и ее нейтрализации, модификации антителом рецепторов токсинов (токсин не может прикрепиться к клетке - мишени), преципитации (осаждения). антибактериальный. Антитела образуются против всех антигенов бактерий, но защитную роль играют антитела, выработанные на протективные антигены. Элиминация бактерий зависит от их локализации. Если бактерии находятся внеклеточно, то их элиминация идет следующими путями: бактерия + антитела + комплемент ->иммунный лизис; антитела способствуют опсонизации бактерий и этим способствуют фагоцитозу. Если бактерии находятся внутриклеточно, то элиминация происходит за счет образования инфекционной гранулемы ( по Т- эффекторному пути). Если организм не ослаблен, то в гранулеме микроорганизм либо погибает, либо долго не остается в жизнеспособном состоянии. В противном случае при распаде гранулемы происходит диссеменация микроба по организму. Противовирусный - зависит от локализации вируса. В основном вирус находится внутри клеток, где живет и размножается. В ходе внедрения в клетку и жизнедеятельности вирус изменяет антигенную структуру клеточной мембраны и на такую клетку вырабатываются Т- киллеры. Кроме того, может образовываться гранулема (Т- эффекторный путь). На внеклеточный вирус вырабатываются антитела, они соединяются с вирусом, и комплекс вирус * антитело захватывается макрофагом. В некоторых случаях имеет место антитело- зависимая цитотоксичность - к клетке с вирусом присоединяется антитело, нормальные киллеры выделяют вещества типа перфорина, которые вызывают гибель клетки путем разрушения ее мембраны. Антигрибковый - близок к антибактериальному, но имеет свои особенности, т. к. в составе гриба имеется много полисахаридов, и грибы могут существовать в виде спор и вегетативных форм. Неспецифические факторы - альтернативный путь активации системы комплемента. Помимо гибели клеток гриба, белки системы комплемента привлекают к грибу воспалительные клетки - развивается воспалительная реакция. Клетки гриба также могут стать объектом действия нормальных киллеров. Возможен гуморальный путь - гриб + антитела + комплемент e лизис. При грибковых заболеваниях вырабатываются иммуноглобулины Е, которые участвуют в развитии аллергических реакций типа гиперчувствительности немедленного типа, это способствует развитию воспаления. Имеет место и клеточный иммунный ответ ( Т- хелперы e g - интерферон e фагоцитоз; Т- эффекторы e инфекционная гранулема). От частой стимуляции Т- супрессоров может возникнуть анергия - отсутствие либо очень слабый иммунный ответ. Противопаразитарный - против простейших и гельминтов. Необходимо учитывать, что многие паразиты имеют несколько стадий развития, соответственно возникают стадия - специфичные антитела. При смене стадии паразит на некоторое время ''уходит'' от действия антител, что затрудняет развитие иммунного ответа. Механизмы - ГИО и КИО. Необходимо учитывать, что простейшие сами выделяют супрессивные факторы, в результате чего возникают вторичные иммунодефициты. Угнетается синтез цитокинов (особенно интерлейкина 2). Паразиты стимулируют выработку макрофагами фактора некроза опухолей (TNF), который является белком воспалительной реакции, поэтому в месте локализации паразита часто бывает воспалительный инфильтрат. В отношении простейших имеют значение и механизмы антитело- зависимой цитотоксичности.
Иммунопрофилактика и иммунотерапия.
Иммунопрофилактика - метод индивидуальной или массовой защиты населения от инфекционных заболеваний путем создания или усиления искусственного иммунитета. Иммунотерапия - лечение инфекционных заболеваний с помощью иммунопрепаратов. Иммунопрофилактика бывает: специфическая - против конкретного возбудителя активная - создание иммунитета путем введения вакцин; пассивная - создание иммунитета путем введения сывороточных препаратов и g - глобулина; неспецифическая - активизация иммунной системы вообще. Типы вакцин:
- живые - готовятся из аттенуированных (ослабленных) штаммов, которые есть в природе. Это противооспенная, I и II серотипы вируса полиомиелита, туляремийная вакцины. Могут быть получены путем селекции (БЦЖ, гриппозная). Они способны размножаться в организме и вызывать вакцинальный процесс, формируя невосприимчивость. Утрата вирулентности у таких штаммов закреплена генетически, однако у лиц с иммунодефицитами могут возникнуть серьезные проблемы.
- убитые - готовят из высоковирулентных штаммов, их убивают физическими (температура, радиация, ультрафиолетовый свет) или химическими ( спирт, формальдегид) методами. Такие вакцины реактогенны, применяются мало (коклюшная, против гепатита А).
- химические - готовят из антигенов бактерий, извлеченных химическим путем (брюшнотифозная, менингококковая).
- анатоксины - представляют собой экзотоксины бактерий, обработанные 0.3 - 0.4% раствором формалина в течении месяца в термостате. В результате такой обработки токсические свойства утрачиваются, но остаются иммуногенные.
- ассоциированные - вакцины типов 1, 2, 3 или 4, содержащие несколько компонентов (АКДС). синтетические - представляют собой искусственно созданные антигенный детерминанты микроорганизмов.
- векторные (рекомбинантные) - получены методом генной инженерии. Суть метода: гены вирулентного микроорганизма, отвечающий за синтез протективных антигенов, встраивают в геном какого - либо безвредного микроорганизма, который при культивировании продуцирует и накапливает соответствующий антиген.
Требования, предъявляемые к вакцинам:
- иммуногенность - должны индуцировать выраженный иммунный ответ;
- безопасность; ареактогенность - не должны вызывать побочных эффектов;
- стабильность - должны сохранять свои свойства;
- стандартизуемость - по числу микроорганизмов, белкам и т.д.;
- возможность ассоциирования.
Поствакцинационный иммунитет.
Поствакцинационный иммунитет - иммунитет, который развивается после введения вакцины. На его развития влияют следующие факторы:
зависящие от самой вакцины - чистота препарата; время жизни антигена; доза наличие протективных антигенов; кратность введения;
зависящие от макроорганизма - состояние индивидуальной иммунной реактивности; возраст; наличие иммунодефицита; состояние организма в целом;
зависящие от внешней среды - питание; условия труда и быта; климат; физико- химические факторы среды.
Экологическая иммунология.
Экологическая иммунология изучает иммунотропные экофакторы, их влияние на иммунную систему организма и на здоровье как индивида, так и целой популяции. Развитие экологической иммунологии актуально из-за расширения сфер деятельности, среды обитания и ухудшения экологической обстановки в худшую сторону. Задачи экологической иммунологии:
- обнаружение и характеристика иммунотропных экофакторов;
- установление связи между механизмами действия иммунотропных экофакторов и изменениями со стороны иммунной системы;
- слежение за действием иммунотропных экофакторов и изменениями со стороны иммунной системы (иммунологический мониторинг);
- устранение вредных факторов и профилактика нарушений функций иммунной системы;
- создание среды, в которой организм мог бы нормально функционировать.
Экологические факторы, влияющие на состояние иммунной системы организма, называют иммунотропными экофакторами. Эти факторы можно разделить на две больших группы:
- природные - температура, радиация, ультрафиолетовое излучение, микроэлементы и т.д.; - антропогенные - ГЭС, АЭС, осушение/орошение земель, выбросы промышленных предприятий, широкое применение химических соединений.
По характеру действия иммунотропные экофакторы можно разделить на: мягкие/жесткие; прямого/опосредованного действия; регулируемые/нерегулируемые; коротко/длительно действующие; локальные/глобальные; аккумулирующиеся/не аккумулирующиеся в организме. Типы реакций организма на воздействие иммунотропных экофакторов: повышение реактивности; возможность развития аллергий и аутоиммунных заболеваний; подавление реактивности; возможность развития иммунодефицитных состояний 2-го типа и рака; лимфопролиферативные процессы; возможность развития лейкозов. Для оценки воздействия иммунотропных экофакторов необходимо прибегать к следующим действиям: измерение иммунотропных экофакторов в организме или дозы их действия; оценка иммунного статуса; установление корреляции между действием иммунотропных экофакторов и степенью изменения со стороны иммунной системы; определение уровня смертности, заболеваемости и продолжительности жизни. На основе этих данных определяют группы риска и проводят иммунокоррекцию.
Клиническая иммунология.
Клиническая иммунология - раздел иммунологии, изучающий функции иммунной системы в норме и патологии. Задачи клинической иммунологии: изучение функций иммунной системы в норме; изучение функций иммунной системы при патологии (больные с аутоиммунными заболеваниями, аллергиями, раком, при осложнениях после хирургических вмешательств, при заболеваниях внутренних органов; выявление, изучение и классификация иммунодефицитных состояний; изучение инфекций иммунной системы (ВИЧ); разработка методов диагностики и оценки иммунного статуса; разработка методов коррекции иммунного статуса; поиск и разработка иммунотропных препаратов; подготовка кадров.
Иммунодефицитные состояния.
Состояния, при которых наблюдается отсутствие или снижение уровня одного или нескольких факторов иммунитета, называют иммунодефицитными. ИДС могут не иметь клинических проявлений. ИДС разделяют на две большие группы: первичные ИДС или ИДС I - генетической природы, 0.05% всех ИДС В- зависимые - нарушена функция В- лимфоцитов (50% ИДС I). Отмечаются нарушения ГИО, повышена чувствительность к инфекциям, вызываемым внеклеточными паразитами; Т- зависимые (30% ИДС I) нарушение дифференцировки Т- лимфоцитов на субпопуляции; нарушения функций тимуса; комбинированные (10% ИДС I, как правило a) и b) ) - очень высокая смертность; нарушения фагоцитарной системы (8% ИДС I) - повышена чувствительность к гноеродным микроорганизмам; нарушения системы комплемента (2% ИДС I) - отмечаются аутоиммунные заболевания, рецидивы гнойных инфекций, повышена чувствительность к гоно- и менингококкам; вторичные ИДС или ИДС II - приобретаются под влиянием следующих факторов: перенесенные инфекционные заболевания; соматические заболевания печени, почек, поджелудочной железы; гормональный дисбаланс; неправильный образ жизни; действие неблагоприятных факторов дома и на работе; применение лекарственных препаратов, угнетающих иммунную систему; радиация; белковое голодание и нарушения белкового обмена. При этих состояниях отмечается дисбаланс со стороны регуляторных субпопуляций Т- лимфоцитов. Активность В- лимфоцитов в этих случаях повышена. Наблюдается дис- g - глобулинемия. Фагоцитарная система страдает мало и не всегда. В отношении комплемента отмечается изменение содержания некоторых его фракций.
Аутоиммунные заболевания.
Аутоиммунные заболевания - это заболевания, для которых характерно развитие иммунного ответа на антигены собственных тканей. Механизм реализации - ГИО и КИО. Доказательства существования таких болезней: обнаружение в сыворотке крови антител к собственным тканям; обнаружение в крови циркулирующих тканевых антигенов; обнаружение в крови циркулирующих иммунных комплексов; обнаружение в крови сенсибилизированных Т- лимфоцитов к собственным тканям; способность аутоантител и аутореактивных клеток ( Т- лимфоциты) повреждать клетки организма; обнаружение в тканях фиксированных иммунных комплексов и признаков повреждения тканей; воспроизведение болезни на животных. Существует две группы аутоиммунных заболеваний: органоспецифичные - характерно повреждение какого-либо органа (полиневрит, тиреоидит); системные - в крови циркулируют иммунные комплексы, которые оседают на эндотнлий сосудов и вызывают активацию системы комплемента, развивается воспаление (васкулит); это могут быть антитела к белкам крови, к ДНК (ревматоидный артрит, системная красная волчанка). Гипотеза развития аутоиммунных заболеваний: появление в организме в результате мутаций ''запрещенных'' клонов Т- и В- лимфоцитов; отмена толерантности (аутореактивные Т- и В- лимфоциты проявляют агрессию к собственным тканям; индукция аутоиммунных процессов перекрестно- реагирующими антигенами; нарушения функций Т- и В- системы лимфоцитов; нарушение органных барьеров (головной мозг, хрусталик, ткань яичка). Аутоиммунные заболевания - это частный случай иммунопатологии. Чаще развиваются у людей с гормональным дисбалансом и у лиц с наличием аномальных локусов генов HLA (см. далее) - например, HLA-B27 - локус маркеров системной красной волчанки.
Иммунный статус организма.
Иммунный статус организма - это количественная и функциональная характеристики отдельных звеньев иммунной системы на определенном этапе развития организма или на определенной стадии развития заболевания. Принципы определения иммунного статуса: двухуровневая оценка (см. далее); определение связи количественных показателей с их функциональной активностью; определение связи иммунологических механизмов с клиническими проявлениями заболевания; учет связи индивидуальной реактивности с генетическими факторами; сравнение показателей иммунного статуса организма с нормой; наблюдение за состоянием иммунного статуса в динамике. Уровни оценки иммунного статуса: первый уровень - ориентировочный, обязателен и включает следующие тесты: В - лимфоциты: количество в крови, уровень иммуноглобулинов A, M, G; Т - лимфоциты; количество в крови; фагоцитарная реакция; активность системы комплемента; второй уровень - аналитический, определяется конкретное звено, в котором имеется нарушение, включает следующие тесты: В - система определение численности и соотношения субпопуляций (Вm , Вa , Вg ); определение способности синтезировать антитела in vitro; определение способности синтезировать антитела in vivo в ответ на введение вакцин; Т - система определение численности и соотношения субпопуляций Т- хелперов и Т - супрессоров ( в норме отношение [Тх/Тс] = 2, если [Тх/Тс] > 4, то идет активация Т- хелперов, если [Тх/Тс] < 1, то идет супрессия; определение численности и соотношения субпопуляций Т - киллеров и Т эффекторов; определение уровня активности Т- хелперов по продукции Ил 2, 3, 4 ,5, 6 и g - интерферона; изучение реакции бласт- трансформации; определение цитотоксичности Т- киллеров; проверка всех стадий фагоцитоза; проверка содержания всех фракций системы комплемента и фрагментов их деградации (C3a, C5a).
Иммунокорригирующая терапия
Иммунокорригирующая терапия (ИКТ) включает в себя: иммуносупрессию - специальное подавление иммунного ответа; иммуностимуляцию - специальная активация иммунного ответа; иммуномодуляцию - одновременная стимуляция звеньев иммунитета с пониженной функцией и супрессия таковых с повышенной. Для проведения ИКТ необходимо ориентироваться на глубину и спектр повреждения иммунной системы и контролировать иммунный статус в процессе лечения. Способы коррекции: заместительная пересадка красного костного мозга, тимуса и грудины; стимуляция иммунокомпетентных клеток интерлейкинами; с помощью препаратов В - активин (миелопептиды красного костного мозга); Т - активин,тималин, тимозин, тимостимулин (препараты тимуса); интерлейкины и g - интерферон, лизоцим (аэрозольно); введение полисахаридов микробного происхождения; гормоны; витамины и микроэлементы. При аутоиммунных заболеваниях, аллергии, предстоящей пересадке органа нужна иммуносупрессия. Вводят препараты, снижающие скорость деления иммунокомпетентных клеток или вызывающие их гибель. Это такие, как антилимфоцитарная сыворотка, кортикостероиды, циклоспорин А (избирательно подавляет функции Т- хелперов, снижается выработка интерлейкинов 2, 4, 5).
Аллергии.
Аллергия - форма иммунного ответа, которая проявляется в развитии специфической повышенной чувствительности организма к чужеродным веществам различного состава и происхождения в результате предшествующего контакта с этим веществом. Вещества, вызывающие аллергию, называют аллергенами. Патогенез, диагностику, профилактику и лечение аллергий изучает аллергология. Причины возникновения аллергий: химизация быта, промышленности, сельского хозяйства; расширение спектра лекарственных средств; большие масштабы иммунопрофилактики; повышение потребления животного белка.
Аллергены.
Аллергены - это химические вещества любой природы, которые при попадании в организм вызывают сенсибилизацию к ним. Разделяют на две большие группы: экзоаллергены; эндоаллергены. Экзоаллергены делятся на: в зависимости от механизма проникновения в организм контактные (через кожу); ингаляторные (через дыхательный тракт); алиментарные (через ЖКТ); парентеральные (через кровь); по происхождению бытовые (пыль, особенно хлопковая); эпидермальные (эпителий, пух, шерсть, перхоть); пыльцевые (пыльца); химические вещества (их более 100 000, такие как лаки, краски, дубильные вещества, растворители, косметика); лекарственные аллергены (антибиотики, сульфаниламидные препараты, вакцины, анальгетики); пищевые (яичный белок, рыба, лактоглобулин, ягоды и фрукты с оранжевым пигментом); аллергены, которыми являются микроорганизмы и их части. Эндоаллергены возникают в организме под действием повреждающих факторов (образование комплекса из клеток собственной ткани с чужеродным веществом не антигенной природы, ''аллергия на свет'' и т.п.).
Аллергическая реакция.
Аллергическая реакция является стадийной, выделяют следующие стадии: сенсибилизация - переход от нормальной реактивности к повышенной к какому-либо веществу. Стадия длится от момента первичного попадания аллергена в организм до формирования иммунной реакции на этот аллерген. Механизмы формируются около 2-х недель, сама сенсибилизация может протекать месяцы, годы и даже всю жизнь. Сенсибилизация может быть активной (сам организм вырабатывает механизмы аллергии) и пассивной (при переливании крови от сенсибилизированных лиц к несенсибилизированным). Факторы сенсибилизации: зависящие от аллергена путь проникновения (чаще парентерально или ингаляторно); доза (чаще на небольшие или сверхбольшие количества - сенсибилизирующая доза); природа аллергена (к некоторым аллергенам - 100%-ая чувствительность); длительность воздействия; от состояния иммунологической реактивности (наследственная предрасположенность к некоторым формам аллергии) В эту стадию нет никаких клинических проявлений, установить можно только с помощью лабораторных методов. Разрешение - возникает в основном на повторное попадание аллергена или (реже) на тот аллерген, который сохраняется в организме более 2-х недель. Это стадия клинических проявлений, которые могут наступать быстро (от нескольких секунд до 6-и часов), это т.н. гиперчувствительность немедленного типа (ГНТ), или медленно (24 - 48 часов) - это т.н. гиперчувствительность замедленного типа (ГЗТ). Десенсибилизация - возврат к нормальной реактивности, может происходить: спонтанно и наступает сам по себе после устранения действия аллергена; искусственно - после курса введения аллергена в микродозах.
Типы аллергических реакций.
Гиперчувствительность немедленного типа. Механизмом ГНТ является ГИО. ГНТ может быть трех типов. I тип - медиаторный, анафилактический. Возникает на экзогенные Т- зависимые антигены. В качестве аллергенов - лекарственные, пыльцевые пищевые и бактериальные антигены. Путь проникновения - парентеральный, ингаляционный, алиментарный. Сенсибилизация протекает с момента попадания аллергена в организм до выработки иммуноглобулина Е, концентрация в крови которого повышается в 20 - 40 раз. С кровью эти антитела заносятся в шоковый орган (тот, в который поступил аллерген -эпителий, слизистые, эндотелий, гладкие миоциты. Иммуноглобулин Е присоединяется к базофилам и тучным клеткам, что ведет к повышению реактивности шоковой ткани. При повторном попадании аллергена наступает стадия разрешения. Протекающая в три фазы: иммунологическая - аллерген соединяется с иммуноглобулинами Е, которые фиксированы на базофилах и тучных клетках. В результате взаимодействия изменяются свойства клеточной мембраны; биохимическая - происходит дегрануляция тучных клеток и базофилов. Выделяется большое количество биогенных аминов и медиаторов - серотонин, гистамин, ацетилхолин, кинин, тромбоксан. В норме они имеются в крови, однако в гораздо меньших концентрациях. патофизиологическая - проявляется действие медиаторов на эндотелий, миоциты, нервные клетки. Проявления: анафилотоксия - возникает чаще на лекарственные препараты, укусы пчел - резкое снижение АД, симптомы удушья, судороги, потеря сознания при анафилотоксическическом шоке. При местной анафилотоксии - те же симптомы, но наступают медленно. атопии - при наследственной предрасположенности, болеет только человек. бронхиальная астма; крапивница (шоковый орган - эпителий кожи и эндотелий сосудов - зуд, повышение температуры); сенная лихорадка (аллергический ринит) - чаще возникает на пыльцевые аллергены, такие заболевания носят название - полинозы. Шоковый орган - эндотелий сосудов носа, гортани, глотки. отек Квинке. Шоковый орган - подкожная жировая клетчатка, губы, твердая мозговая оболочка; детская экзема - на пищевые продукты. II тип - цитотоксический - развивается на простые химические вещества, компоненты клеточной мембраны, неклеточные структуры. Условие возникновения - много аллергена, аллерген прикрепляется к клеткам (например, к эритроцитам). Шоковые клетки - чаще всего клетки крови, эндотелий сосудов, гепатоциты, эпителий почек. Когда аллерген прикрепляется к клеткам, то их поверхность становится антигенно - чужеродной, возникает гуморальный иммунный ответ, синтезируются иммуноглобулины G, разрушаются клетки, аллерген исчезает. Это явление получило название антитело-зависимой цитотоксичности. Проявления: гемолитическая анемия, лейкопения, тромбоцитопения, гломерулонефрит, иммунный тиреоидит, поражения печени, сердца. III тип - иммунокомплексный. Развивается на большие дозы аллергена при условии недостаточности фагоцитарной активности. При первом попадании аллергена на него вырабатываются иммуноглобулины G и A. При повторном попадании аллерген взаимодействует с иммуноглобулинами с образованием циркулирующих иммунных комплексов. Эти иммунные комплексы адсорбируются эндотелием, превращаясь в фиксированные иммунные комплексы. Происходит активация комплемента, образуются фракции C3a, C4a, C5a, которые повышают проницаемость сосудов и являются хемотаксинами для нейтрофилов. Вокруг сосудов образуется очаг воспаления - системный васкулит. При разрушении нейтрофилов выделяются протеазы, которые разрушают сосуды и ткани. Проявления:
- ''сывороточная болезнь'' - отек кожи, подкожной жировой клетчатки, слизистых, повышение температуры тела, сыпь, поражение коллагеновых волокон, поражения суставов.
- феномен Артюса - при многократном локальном введении разрешающей дозы антигена (при многократных инъекциях в одно место). Шоковый орган - в месте введения. Образующиеся антитела формируют иммунные комплексы, которые оседают на эндотелии сосудов, идет активация системы комплемента, повреждается сосуд, развивается ишемия тканей, затем некроз и в итоге развивается стерильный абсцесс.
- гломерулонефрит - иммунные комплексы не могут отфильтроваться в почечном фильтре, осаждаются на эпителии почечных канальцев, идет активация системы комплемента, повреждается сосуд, развивается ишемия тканей, затем некроз и в итоге развивается стерильный абсцесс.
- ревматоидный артрит*;
- системная красная волчанка*;
- тиреоидит Хашимото*;
- гепатит; инфекционные заболевания;
- опухоли.
Образование иммунных комплексов идет и в норме, они быстро захватываются и разрушаются. Этот тип аллергии возникает при условии недостаточной элиминации иммунных комплексов вследствие превышения скорости образования над скоростью элиминации, образования неэлиминирующихся иммунных комплексов, дефицита системы комплемента, дефицита фагоцитарной системы.
Гиперчувствительность замедленного типа (ГЗТ).
Это IV тип аллергии, его механизм - КИО. Чаще развивается на: простые химические вещества гаптенной природы; на микробные аллергены при хронических процессах; на лекарственные аллергены; на собственные измененные клетки. Фаза сенсибилизации представляет собой формирование иммунного ответа по клеточному типу. В результате этого образуется много Т- эффекторов и Т- киллеров. Фаза разрешения наступает через 24- 48 часов, во время которой в иммунологическую фазу сенсибилизированные Т- лимфоциты распознают антигены; биохимическую фазу происходит синтез лимфокинов и активация клеток; патофизиологическую фазу развивается воспалительная реакция. Итак, в фазу разрешения Т- эффекторы выделяют лимфокины, из которых наиболее важны: хемотаксический фактор - привлекает лейкоциты, фибробласты; фактор торможения миграции; фактор проницаемости; фактор активации макрофагов; фактор пролиферации. Проявления: контактная аллергия - развивается на простые химические вещества (гаптены). Проникают в кожу, соединяются с кератином и превращаются в полноценные антигены, на них образуются Т- эффекторы. При повторном контакте с аллергеном в результате действия Т- эффекторов наблюдается периваскулярная мононуклеарная инфильтрация кожи и фокальная инфильтрация эпидермиса. Образуются фолликулы (в фолликулах клеток мало, кожа сухая, краснеет, трескается), и везикулы (пузырьки на коже, зуд; пузырьки лопаются, развивается экзема, которая может осложниться нагноением). инфекционная аллергия - образуется гранулема. 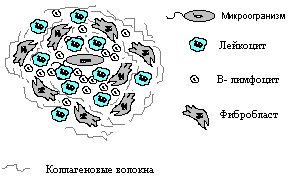 В центре гранулемы находится микроорганизм, вокруг - вал лейкоцитов и В- лимфоцитарная инфильтрация. На периферии - фибробласты, которые продуцируют коллагеновые волокна. Функция гранулемы - ограничение инфекции. Микроорганизм в гранулеме защищен от влияния факторов клеточного и гуморального иммунитета и поэтому может долго сохранять свою жизнеспособность. При некоторых условиях гранулема может распадаться, тогда, если микроорганизм еще жизнеспособен, может возникать рецидив заболевания. При благоприятном исходе гранулемы могут обызвествляться.
В центре гранулемы находится микроорганизм, вокруг - вал лейкоцитов и В- лимфоцитарная инфильтрация. На периферии - фибробласты, которые продуцируют коллагеновые волокна. Функция гранулемы - ограничение инфекции. Микроорганизм в гранулеме защищен от влияния факторов клеточного и гуморального иммунитета и поэтому может долго сохранять свою жизнеспособность. При некоторых условиях гранулема может распадаться, тогда, если микроорганизм еще жизнеспособен, может возникать рецидив заболевания. При благоприятном исходе гранулемы могут обызвествляться.
Регуляция иммунного ответа.
Иммунный ответ различается качественно и количественно. Качественные различия иммунного ответа обеспечиваются наличием IR- генов (генов иммунного ответа), в то время как количественные различия имеют как генетическую, так и функциональную природу. Генетические фауторы являются наиболее важными в обеспечении способности иммунной системы реагировать на внедрение антигена.
Физиологическая регуляция.
Супрессия Т- клетками.
Развитие Т- супрессоров стимулируется пролиферирующими Т- хелперами, которые одновременно и тормозятся (пример отрицательной обратной связи). Т - супрессоры образуются преимущественно в образованиях, бедных макрофагами, например в Пееровских бляшках кишечника, при поступлении антигена per os. T- супрессоры делятся на:
- Т- супрессоры 1 - подавляют тимус- зависимую продукцию антител;
- Т- супрессоры 2 - подавляют продукцию антител на специфические антигены.
Положение о прямом воздействии Т- супрессоров на В- лимфоциты спорно, главный эффект Т- супрессоров заключается в подавлении активности Т- хелперов.
Супрессия антителами
Ig G могут избирательно подавлять продукцию антител, особенно Ig М. Такое ингибирование наблюдается у плода и новорожденного материнскими антителами и используется при назначении беременным анти-Rh IgG для предотвращения резус-конфликта. Антитела также образуются к идиотипическим детерминантам некоторых антиген- связывающих участков (Fab) молекул иммуноглобулинов - это т.н. антиидиотипические антитела. Этот феномен возможен потому, что вариабельная область каждой молекулы иммуноглобулина уникальна для антитела, синтезируемого отдельно взятым клоном клеток. Этот ряд может быть очень длинным, то есть антиидиотипические антитела могут сами иметь идиотопы, которые, в свою очередь, будут распознаваться другими антиидиотипическими антителами, и т.д.. Антиидиотипические антитела могут подавлять подукцию их идиотипических антител, блокируя рецепторы на В- и Т- лимфоцитах. Подобные антиидиотипические антитела используются в лечении В- клеточных лимфом и некоторых аутоиммунных болезней (идиопатическая тромбоцитопеническая пурпура, миастения gravis) с целью подавления клеток с идиотип - специфическими маркерами на их поверхности, продуцирующих аутоантитела.
Генетическая регуляция.
Генетическая регуляция обеспечивается IR- генами 2, 6, 7, 14 и 22 хромосом.
| ХРОМОСОМА | ГЕНЫ |
| 2 | МНС, другие IR- гены |
| 6 | синтеза н- цепи иммуноглобулина |
| 7 | синтеза рецепторов Т- лимфоцитов |
| 14 | синтеза н- цепи Ig, рецепторов Т- лимфоцитов |
| 22 | синтеза l - цепи иммуноглобулина |
Т- и В-лимфоциты имеют гены, ответственные за синтез константных участков иммуноглобулинов (С- гены), вариабельных (V- гены) и полипептидов, обеспечивающих объединение иммуноглобулинов М в пентамеры (J- гены). Мутации и рекомбинации, происходящие с этими генами, обеспечивают многообразие антител и рецепторов Т- лимфоцитов.
Система HLA.
Система HLA (human leukocyte antigens) - группа тканевых антигенов, являющихся продуктами генов МНС. HLA- антигены найдены на всех ядерных клетках человека в различном количестве. Иммунный ответ на этот антиген является главной причиной реакции ''трансплантат-хозяин''. HLA - антигены контролируются генами главного комплекса гистосовместимости, который располагается в коротком плече 6- ой хромосомы. Гены или локусы системы HLA входят в три региона, каждый из которых имеет характерные генные продукты и функции. Эти регионы носят название ''классы'' - класс I, класс II и класс III. Продуктами генов класса I являются гликопротеиновые молекулы, экспрессированные на мембране почти всех ядросодержащих клеток. Регион класса II (D- область) состоит из субрегионов. Гены DP-, DQ- и DR- субрегионов кодируют HLA- молекулы с выраженным антигенным полиморфизмом. Регион класса III содержит гены, которые непосредственно вовлечены в иммунную функцию.
| Гены | Продукт экспрессии |
| DP | a - и b - цепи Аг II класса |
| DQ | a - и b - цепи Аг II класса |
| DR | a - и b - цепи Аг II класса |
| BF | фактор В системы комплемента |
| C2 | белок С2 системы комплемента |
| C4 | белок С4 системы комплемента |
| TNF | фактор некроза опухолей |
| B, C, A | полипептиды Аг I класса |
Большинство генов HLA высоко полиморфны, т.е. в популяции в определенном локусе HLA могжет располагаться множество аллелей. Идентифицировано 24 аллели для HLA-A, 20 - для DR, 11 - для С, 9 - для DQ, 6 - для DP, 52 - для В, 26 - для D, таким обраэом количество антигенных комбинаций огромно (24х20х11х9х6х52х26 = 385.482.240). Наследование HLA- генов происходит по кодоминантному признаку, при котором у потомства в одинаковой степени экспрессируются HLA- аллели, полученные от каждого из родителей.


 В структуре иммуноглобулина можно выделить: константные области ( > ? H и ? L), в них постоянная последовательность аминокислот; вариабельные части; гипервариабельные участки; шарнирные области - необходимы для изменения конформации, в них есть участки связывания белков системы комплемента. При обработке молекулы иммуноглобулина папаином он распадается на два фрагмента - Fab (Fragment antigen - binding) и Fc. С- концевой участок H- цепей служит для прикрепления к клеточному Fc- рецептору. Fc- фрагмент способен активировать систему комплемента, обеспечивает способность иммуноглобулина G проходить через биомемрану (проходит через фетоплацентарный барьер), определяет цитофильность, оказывает опсонизирующее действие на объекты фагоцитоза. Любой иммуноглобулин имеет как минимум 2 активных центра, а если молекулы объединены в полимер - и более. Иммуноглобулины разделяют на классы, а те, в свою очередь, на подклассы. Класс иммуноглобулина соответствует типу тяжелой цепи - следовательно, существует 5 классов иммуноглобулинов: G (d), M (m), A (a), D (d), E (e).
В структуре иммуноглобулина можно выделить: константные области ( > ? H и ? L), в них постоянная последовательность аминокислот; вариабельные части; гипервариабельные участки; шарнирные области - необходимы для изменения конформации, в них есть участки связывания белков системы комплемента. При обработке молекулы иммуноглобулина папаином он распадается на два фрагмента - Fab (Fragment antigen - binding) и Fc. С- концевой участок H- цепей служит для прикрепления к клеточному Fc- рецептору. Fc- фрагмент способен активировать систему комплемента, обеспечивает способность иммуноглобулина G проходить через биомемрану (проходит через фетоплацентарный барьер), определяет цитофильность, оказывает опсонизирующее действие на объекты фагоцитоза. Любой иммуноглобулин имеет как минимум 2 активных центра, а если молекулы объединены в полимер - и более. Иммуноглобулины разделяют на классы, а те, в свою очередь, на подклассы. Класс иммуноглобулина соответствует типу тяжелой цепи - следовательно, существует 5 классов иммуноглобулинов: G (d), M (m), A (a), D (d), E (e).  В центре гранулемы находится микроорганизм, вокруг - вал лейкоцитов и В- лимфоцитарная инфильтрация. На периферии - фибробласты, которые продуцируют коллагеновые волокна. Функция гранулемы - ограничение инфекции. Микроорганизм в гранулеме защищен от влияния факторов клеточного и гуморального иммунитета и поэтому может долго сохранять свою жизнеспособность. При некоторых условиях гранулема может распадаться, тогда, если микроорганизм еще жизнеспособен, может возникать рецидив заболевания. При благоприятном исходе гранулемы могут обызвествляться.
В центре гранулемы находится микроорганизм, вокруг - вал лейкоцитов и В- лимфоцитарная инфильтрация. На периферии - фибробласты, которые продуцируют коллагеновые волокна. Функция гранулемы - ограничение инфекции. Микроорганизм в гранулеме защищен от влияния факторов клеточного и гуморального иммунитета и поэтому может долго сохранять свою жизнеспособность. При некоторых условиях гранулема может распадаться, тогда, если микроорганизм еще жизнеспособен, может возникать рецидив заболевания. При благоприятном исходе гранулемы могут обызвествляться.