Перевод А. Белоусов, sarcoidosis@yandex.ru
Глава 3
Этиологии саркоидоза
L.S. Newman
Correspondence: L.S. Newman, Division of Environmental and Occupational Health Sciences, Dept of Medicine, National Jewish Medical and Research Center, 1400 Jackson St, Room G212, Denver, Colorado 80206, USA. Fax: 1 3033981983; E-mail: newmanl@njc.org
Почему этиология саркоидоза неизвестна?
Мог ли кто-нибудь предположить, что почти через 130 лет после первого описания, никто не раскроет причину саркоидоза. Эта неудача говорит о комплексности проблемы, начиная с воздействия окружающей среды, заканчивая генетическими факторами. Начиная с самых ранних описаний, саркоидоз считался инфекционной болезнью и все же, до настоящего времени, хотя предлагалось очень много различных микроорганизмов, ни разу не было убедительно доказано, что они являются причиной саркоидоза. Интересно, что в этом же самом столетии, причины многих идиопатических болезней были обнаружены, причем большинство из них были инфекционными. Они включают малярию (Plasmodium falciparum), сибирскую язву (Bacillus anthracis), общее истощение организма или чахотку (Mycobacterium tuberculosis), язву желудка (Helicobacter pylori) и болезнь Уиппла (Tropheryma whippelii). В большинстве этих и других случаев, постулаты Генле-Коха были выполнены.
Несколько поколений исследователей саркоидоза столкнулись с тем, что выполнение этих постулатов не является легким вопросом. Это происходит потому, что не все организмы могут быть изолированы или культивированы, остается неизвестным истинный спектр и патогенных и непатогенных микроорганизмов, некоторые микроорганизмы могут быть эндогенными для хозяина, некоторые микроорганизмы, колонизирующие хозяина, могут вызывать патологию посредством их антигенных или адъювантных свойств, но не вследствие инфекции per se (в чистом виде). Следовательно, несмотря на многие попытки, обнаружить микробный патоген удовлетворяющий постулатам Коха, было трудно. Существуют определенные опасения, что при обнаружении и культивировании организма не были использованы правильные условия, что причина саркоидоза не является микробной или болезнь называемая ''саркоидозом'' состоит из болеее чем из одной болезни, каждая из которых может иметь различную причину [1, 2].
Могут иметься другие причины, почему этиология саркоидоза остается неизвестной.
1) Определение болезни: обзор медицинской литературы показывает, что исследователи использовали крайне вариабельные, неточные и противоречивые определения болезни [4]. Этот недостаток может быть улучшен посредством применения единых руководящих принципов для определения саркоидоза [5]. При клинических исследованиях саркоидоза необходимо использовать систематическую и более строгую методологию.
2) Идентификация случаев болезни: различия в принципах подбора пациентов в исследования производят систематическую ошибку и делают трудным сравнение групп пациентов в различных исследованиях.
3) Гетерогенность болезни: широкий диапазон клинических паттернов саркоидоза [6] увеличивает возможность, что саркоидоз а) может быть не одной болезнью, б) может быть вызван более чем одним этиологическим агентом, в) единственный агент способен производить различные эффекты, основанные на факторах хозяина, например генетических.
4) Время начала болезни: даже при том, что в некоторых исследованиях была обнаружена временная группировка саркоидоза, время между воздействием предполагаемого причинного агента и началом болезни остается неизвестным. Это делает трудным определение, что и когда вызвало болезнь.
5) Отсутствие чувствительных и специфических диагностических тестов: диагноз саркоидоз зависит от сочетания клинических признаков и исключения известных причин болезней, которые похожи на саркоидоз [5]. Для саркоидоза не имеется диагностических тестов с высокой чувствительностью и специфичностью. Даже тест Квейма-Зильцбаха, который обладает способностью производить гранулемы, является отрицательным в большом числе случаев. Последствием этого являются ошибочные диагнозы и пропуск болезни. Даже при том, что современные диагностические критерии требуют присутствия неказеозных гранулем, это требование не является патогномоничным.
6) Признание саркоидоза ''идиопатической'' болезнью: когда клиницисты и исследователи наблюдают пациентов с саркоидозом, они вынуждены полагать, что случай может быть идиопатическим. В результате, они часто не исследуют причины гранулематозной болезни у пациента вне рутинных культуральных исследований и окрашивания биопсийного материала для поиска инфекционных болезней.
7) Ограниченные возможности для обнаружения воздействий: кроме доступных культуральных и минералогических методов анализа ткани in situ, окрашивания для поиска микроорганизмов или микробных антигенов и нескольких иммунологических тестов, которые помогают отличить саркоидоз от других болезней, например от хронической бериллиевой болезни, аллергического пневмонита и инфекции, выбор инструментов для идентификации предшествующих воздействий окружающей среды ограничен. Определенные успехи по идентификации микробных антигенов у пациентов с саркоидозом были сделаны в области протеомики, но эти методы пока развиты слабо и должны использоваться вместе с другими методами, чтобы установить этиологию саркоидоза [7-9]. Эпидемиологические методы могут помогать идентифицировать факторы риска окружающей среды, но до настоящего времени они лишь помогли сузить спектр возможных причин. Иммунологические исследования показали, что антигены важны в патогенезе саркоидоза, но сложности идентификации антигена иммунологическими, биохимическими, эпидемиологическими и микробиологическими методами, обескураживают.
8) Комплексное действие генетических и других факторов хозяина: очевидно, что люди отличаются по их восприимчивости к саркоидозу. Генетические факторы связаны со специфическим паттерном болезни (клинический фенотип), риском болезни, с серьезностью и прогрессом болезни [10-16]. Факторы хозяина, такие как табакокурение, также изменяют риск болезни [17]. Вследствие этого, даже если специфический фактор окружающей среды будет идентифицирован, весьма вероятно, что он будет взаимодействовать с генетикой индивидуума и влиять на риск болезни. Имеются серьезные основания для выдвижения гипотезы что саркоидоз вызывается антигенами окружающей среды у наследственно восприимчивых индивидуумов.
Легкие и кожа, два наиболее часто поражаемых органа при саркоидозе, регулярно находятся в контакте с антигенами окружающей среды. Иммунопатогенетические исследования говорят, что саркоидоз - это чрезмерный ответ на антигены [18-24]. Имеется много антигенов окружающей среды, которые могут стимулировать клеточный иммунный ответ, ответственный за развитие гранулем [25-27]. Как показано в таблице 1, факторы окружающей среды вызывают разнообразные гранулематозные болезни, похожие на саркоидоз, включая: хроническую бериллиевую болезнь вследствие ингаляции бериллия и другие гранулематозные болезни легкого, индуцированные металлами (алюминий, титан, цирконий) [28]; аллергический пневмонит, вследствие воздействия органических и неорганических антигенов; и инфекции, такие как туберкулез, атипичные микобактерии и грибы [2, 5]. Неорганическая пыль и минеральные волокна, такие как тальк, кварц, асбест и искусственные минеральные волокна, могут рассматриваться как другой класс воздействий окружающей среды, которые стимулируют саркоид-подобную болезнь, возможно, стимулируя менее специфический врожденный иммунный ответ, который возможно может стимулировать иммунный ответ на другие антигены [29-32]. Список агентов, способных стимулировать гранулематозный ответ у экспериментальных животных еще более длинный, и включает микобактерии, споры грибов, амебы, яйца шистосом, пропионибактерии, карраген, бактерии рода Brucella и лейшманию [27].
Таблица 1. Болезни, при которых формируются гранулемы и потенциальные этиологии саркоидоза
| Категория | Подгруппа | Примеры |
| Инфекции | Грибы | Histoplasma spp., Aspergillus spp., Coccidioides spp. |
| Простейшие | Toxoplasma, Leishmania | |
| Метазоа | Schistosoma | |
| Спирохеты | Treponema pallidum | |
| Микобактерии | Mycobacterium tuberculosis, M. leprae | |
| Бактерии | Yersinia spp., Brucella spp., Borrelia spp., Propionibacteria | |
| Вирусы | Epstein-Barr virus, Herpes, Rubella, Measles, Cytomegalovirus, Coxsackie B virus | |
Опухоли | Карцинома, саркома | Злокачественная назальная гранулема. Гранулемы, ассоциированные с опухолью. |
| Металлы | Бериллий, аллюминий, цирконий, титан | |
| Неорганическая пыль | Кварц, тальк, искусственные минеральные волокна, крахмал, силикон. | |
| Органическая пыль | Аллергический пневмонит | Легкое фермера, легкое любителей птиц, пневмокониоз. |
| Предполагаемые агенты саркоидоза | Пыльца сосны, глина. | |
| Иммунные болезни | Идиопатические | Саркоидоз, болезнь Крона, первичный билиарный цирроз, гигантоклеточный артериит, общая вариабельная иммунная недостаточность |
| Васкулиты | Гранулематоз Вегенера, синдром Черджа-Строса, лимфоматоидный гранулематоз, бронхоцентрический гранулематоз, узловой полиартеиит | |
| Прочие | Синдром Блау | Хроническая гранулематозная болезнь детей |
Значение эпидемиологических исследований этиологии саркоидоза
За последние 50 лет было проведено множество эпидемиологических исследований саркоидоза, позволивших сузить область возможных этиологических агентов. При объединении результатов этих исследований, появляется все более контрастная картина этиологии саркоидоза. Ни в одном из исследований не удалось определить причину саркоидоза, но они позволили сделать некоторые заключения и выдвинуть специфические гипотезы, заслуживающие дальнейшего исследования. Преобладающей точкой зрения этих исследований является то, что саркоидоз является следствием воздействия одного или более агентов окружающей среды, взаимодействующих с генетическими факторами хозяина [2, 5, 33-35]. Будущие исследования должны идентифицировать и связать эти факторы окружающей среды с генетической восприимчивостью. Различные кластеры болезни хорошо известны и, в конечном счете, должны привести нас к этиологии саркоидоза. Для любого предполагаемого причинного агента должно быть правдоподобно объяснено, почему происходят различные формы группировки болезни.
Возраст-специфическая группировка
Болезнь имеет склонность развиваться у молодых взрослых и является довольно редкой у детей и подростков [36] и относительно редкой в пожилом возрасте (старше 70 лет) [37-39]. Это наблюдение может говорить, что воздействие этиологического агента, вне зависимости от того, является ли он антигеном или инфекционным агентом, может происходить, когда индивидуум достигнет возраста, когда он начинает работать, что поднимает вопрос о профессиональных воздействиях.
Раса-специфическая группировка
Болезнь более часто происходит среди афро-американцев, чем среди белых [38-41]. Как это ни парадоксально, подобная группировка также происходит у индивидуумов из северной Европы, особенно с острыми формами болезни (синдром Лёфгрена). Данные говорят, что серьезность болезни и ее прогноз зависят от расы и этнической принадлежности. Исследования генетики острого саркоидоза предположили наличие сильной генетический детерминанты у скандинавских пациентов, которая может объяснить некоторые из этих различий [42-44].
Пол-специфическая группировка
Хотя различные исследования дают различное отношение числа мужчин к числу женщин при саркоидозе, большинство их них получили немного более высокую частоту развития болезни у женщин. Подобная тенденция наблюдалась в исследовании заболеваемости саркоидозом в США (5.9/100,000 для мужчин и 6.3/100,000 для женщин) [45]. Однако, в исследовании также было отмечено увеличение заболеваемости в период 1946-1975 г. у женщин. Henke с колл. [45] выдвинули гипотезу, что увеличение заболеваемости саркоидозом среди женщин возможно наблюдалось из-за того, что ранние проявления саркоидоза у женщин более агрессивны по сравнению с мужчинами. Альтернативная гипотеза - то, что большее число женщин в этот период поступили на работу, где они контактировали с антигенами окружающей среды, которые стимулируют развитие болезни.
Сезонная группировка
Многочисленные исследования обнаружили склонность саркоидоза становиться клинически очевидным зимой и ранней весной, с пиком в весенние месяцы [46-52]. Если предположить, что время между воздействием причинного агента и развитием симптомов саркоидоза находится в пределах от нескольких недель до нескольких месяцев, как это имеет место в животных моделях [27], кажется вероятным, что воздействие может происходить в период поздняя осень - ранняя весна. Интересным является предположение, что увеличение контакта с этиологическим агентом, вне зависимости от его природы, происходит, когда люди проводят большее количество времени в закрытом помещении, на работе или дома в течение зимних месяцев. Можно предположить, что саркоидоз связан с воздействием воздушнокапельных антигенов или инфекционных агентов (так называемых биоаэрозолей), связанных со зданиями, подобно аллергическому пневмониту, лихорадке, связанной с увлажнителями воздуха, Понтиакской лихорадке и легионеллезу [35, 53, 54].
Географическая группировка
Не все исследования географической группировки саркоидоза находятся в согласии друг с другом [41, 55-57]. Несмотря на несоответствия, методологические и систематические ошибки, связанные с подбором случаев болезни и контрольной группы и другие проблемы этих исследований, было показано, что болезнь наблюдается в географически четко очерченных регионах [41, 59-61]. Такое географическое распределение болезни породило много предположений и большое количество исследований метеорологических факторов и почвы [40, 56, 62-66], растений, сосновой пыльцы и близости к лесам [61, 63-70], водоснабжения [40], использования дров для отопления [40, 63- 66], сельскохозяйственных и домашних животных [40, 63-66]. Некоторые исследования отметили группировку саркоидоза в регионах, где сильно развита деревообрабатывающая промышленность [67, 71]. В частности, исследование Dunner и Williams [71] предложило, что случаи саркоидоза просходят вдвое более часто в регионах, где преобладают лесозаготовка и деревообрабатывающее производство.
Kajdasz с колл. [72] на примере группировки болезни на Атлантическом побережье в штате Южная Каролина подтвердили, что географические факторы связаны с риском саркоидоза. Шведское исследование Gripenback с колл. [73] недавно возродило гипотезу влияния сосновой пыльцы, сообщив о накоплении в легком T-лимфоцитов и эозинофилов после воздействия сосновой пыльцы. Однако, исследование ACCESS [35] в исследовании 706 случаев саркоидоза и согласованной контрольной группы, не обнаружило связи болезни с профессиями, связанными с деревообработкой или древесной пылью, с использованием древесины дома или на работе. Это исследование сформировало контрольную группу на основании префикса телефонного номера или, в некоторых случаях, почтового индекса, таким образом согласовав контрольную группу по географическим и возможно региональным факторам окружающей среды.
Таким образом, большинство исследований, которые использовали географическое распределение болезни как средство для установления причины саркоидоза, не были подтвержденны последующими исследованиями, у них отсутствовало биологическое правдоподобие или они не были доведены до конца. Как правило, эти исследования не рассматривали антигены, которые обычно связывают с древесиной и которые, как известно, вызывают гранулематозную болезнь в форме аллергического пневмонита. Они включают термофильные бактерии и грибы, такие как Merulium lacrymans, Aspergillus spp., Penicillium spp. и Trichosporon cutaneum. Например, существует интересная аналогия между саркоидозом и ''аллергическим пневмонитом летнего типа'' в Японии [74]. При этой гранулематозной болезни, наблюдается семейная группировка рекуррентных сезонных респираторных и системных симптомов, причем их начало совпадает с переселением в летние дома, в которых находятся влажные и прогнившие деревянные и соломенные циновки, загрязненные T. cutaneum [74-76].
Группировка, связанная с сельским хозяйством
Многие исследования связали саркоидоз с проживанием, местом рождения или временем, проведенным в сельской местности [37, 41, 56, 67, 68, 77, 78]. В 1961 г. Buck с колл. [63-66], провели обширное исследование дизайна случай-контроль гипотезы связи саркоидоза с сельской местностью. Пациенты с саркоидозом по сравнению с контрольной группой более часто были рождены в сельской местности, жили в сельских районах до постановки диагноза и провели большее совокупное время в сельской местности. К сожалению, это исследование использовало данные относительно небольшой группы пациентов, отсутствовало точное определение болезни, треть контрольной группы была взята из городской венерологической клиники, что привело к систематическим ошибкам. Ранее, Kajdasz с колл. [59, 72] подтвердили связь с проживанием в сельской местности и исследовали различные аспекты сельской жизни, включая печи и камины, которые топили дровами. Все эти исследования говорят, что саркоидоз более часто происходит в сельской местности, чем в городах. В исследовании ACCESS, авторы наблюдали увеличенное значение OR (отношение шансов) среди индивидуумов, работавших в сельском хозяйстве и живших в маленьких городах (менее 50,000 жителей) в детстве [35]. Таким образом, проживание в сельской местности является интересной гипотезой, хотя у городского населения болезнь также происходит [38].
Пространственная группировка
Кроме географической группировки, многие исследования сообщили, что саркоидоз имеет тенденцию происходить у индивидуумов, которые имеют близкий физический контакт друг с другом или близкое расположение в обществе. Например, Parkes [60] и Hills [79] в исследовании 1987 г. постоянных жителей острова Мэн, получили данные, что 40 % из 96 случаев саркоидоза сообщили о предшествующем контакте с человеком, имевшем саркоидоз, по сравнению с 1-2 % контрольной группы. Из этих контактатировавших пар, у 14 контакт произошел при ведении общего домашнего хозяйства, 9 из них были кровными родственниками. 19 пар имели контакт друг с другом на работе, две пары были соседями и 14 были друзьями, не живущими вместе [60, 79]. Такая пространственно-временная группировка саркоидоза может говорить, что саркоидоз - инфекционная болезнь [60, 79].
Если эти же данные рассматривать в контексте воздействия окружающей среды или профессиональных рисков, эти случаи могли бы иметь общее воздействие фактора окружающей среды дома или на работе. К сожалению, в исследовании саркоидоза на острове Мэн было изучено очень малое число профессий и факторов окружающей среды. Интересным является наблюдение, что 18.8 % пациентов с саркоидозом были работниками здравоохранения (особенно медсестрами), что значительно выше, чем в контрольной группе (4.2 %) [60]. Это наблюдение поднимает вопрос, что такие исследования могут иметь систематическую ошибку, связанную с лучшим доступом к услугам здравоохранения. Поэтому, работники здравоохранения имеют большую вероятность быть диагностированными, и, таким образом, быть учтенными в исследованиях, чем индивидуумы, не связанные с системой здравоохранения [80, 81]. Другие сообщения о возникновении саркоидоза у жены и мужа, также могут указывать на общий фактор окружающей среды [82, 83]. Необходимо проведение проспективных исследований, чтобы определить частоту, с которой группировка саркоидоза происходит среди индивидуумов с общими факторами окружающей среды на работе и дома и исследовать большее количество деталей, характеризующих эти среды.
Семейная группировка
Многочисленные исследования сосредоточились на способности саркоидоза происходить в семьях, у пар ребенок-родитель одного пола, ребенок-мать, родных братьев/сестер одного пола и у монозиготных близнецов [39, 63-66, 82, 84-86]. Недавно проведенное исследование показало, что семейная группировка саркоидоза более обычна среди афро-американцев, чем среди белых [87]. Интересно, что в исследовании ACCESS Rybicki с колл. [39] оценили относительный семейный риск (RR) в 10,862 и 17,047 у родственников 706 пациентов с саркоидозом первой и второй степени родства, соответственно. Родные братья/сестры имели самый высокий риск (OR=5.8; доверительный интервал=2.1-15.9), с существенным увеличением риска у дядей/тетей, прародителей и родителей. Белые пациенты имели заметно более высокий RR чем афро-американцы (OR=18.0 против 2.8; p=0.098). McGrath с колл. [88] сообщили, что у белых родных братьев/сестер RR составлял от 36 до 73. Более сложный генетический анализ сцепления показал [89], что наследственный риск является сложным и полигенным [13, 90-99]. Даже если будет установлено, что генетические факторы риска саркоидоза существуют, весьма вероятно, что развитие болезни будет зависеть от воздействия антигенов окружающей среды [18, 33]. Интересно, что почти все исследования семейной группировки саркоидоза были сосредоточены только на генетических факторах, без внимания к общим для членов семьи факторов окружающей среды. Исключением является недавнее исследование Kucera с колл. [34], в котором данные о воздействии окружающей среды были собраны у 921 родственника 273 афро-американцев с саркоидозом.
Промышленность и профессиональные риски
Некоторые из исследований предполагают возможность общего воздействия, стимулирующего формирование гранулемы, на работе [55, 60, 65-67, 71]. До настоящего времени, очень немногие исследования систематически исследовали профессиональные факторы и воздействия окружающей среды у пациентов с саркоидозом. Как и другие эпидемиологические исследования, описанные выше, они изучали возможную роль промышленности или профессии, имели систематические ошибки, связанные с подбором группы, часто использовали неточные определения случаев саркоидоза, не имели контрольную группу или использовали несогласованную контрольную группу и использовали методологию, которая была неспособна определить сосуществующие или преморбидные профессиональные факторы риска [33]. Кроме того, большинство исследований были сосредоточены скорее на профессиях и отраслях промышленности, с которыми были связаны пациенты во время постановки диагноза, чем на систематических исследованиях воздействия профессиональных факторов в течение всей жизни до постановки диагноза. Тем не менее, недавние сообщения, опирающиеся на данные исследования ACCESS [100, 101], исследование, проведенное в штате Южная Каролина в США [72] и исследование профессиональных факторов риска в чернокожих семьях [34], помогли установить, что профессиональные факторы и факторы окружающей среды вносят вклад в риск саркоидоза.
В 1959 г. Cummings с колл. [67] исследовали истории болезни 1,194 пациентов, идентифицированных в госпиталях ветеранов США, у которых саркоидоз был диагностирован в период 1949-1954 г. В этом большом ряде случаев, не использовалось точное определение саркоидоза, не проводилась верификация диагноза с помощью рентгенограммы или гистопатологических исследований и не имелось контрольной группы. Географическое распределение болезни было определено, используя информацию о месте рождения. Авторы наблюдали группировку случаев саркоидоза в 50 регионах США. В 40 из 50 регионов, лесная или лесоперерабатывающая промышленность были основными местными производствами. Авторы заключили, что это может быть стоящей целью для будущих исследований.
Два других исследования ретроспективно собрали профессиональные данные из историй болезни в госпиталях ветеранов США [63-66, 71]. В исследовании Dunner и Williams [71], данные о профессии были получены при рассмотрении историй болезни 500 пациентов с саркоидозом. Профессия пациентов с саркоидозом была сравнена с контрольной группой, состоящей из госпитализированных ветеранов без саркоидоза. Без представления любых фактических данных, Dunner и Williams [71] сообщили, что они идентифицировали большее количество почтовых работников и механиков среди ветеранов с саркоидозом, чем в контрольной группе.
Keller [55] выполнил ретроспективный обзор историй болезни 420 пациентов из госпиталей ветеранов США в период 1960-1964 г. Исследование использовало контрольную группу, состоящую из 420 индивидуумов, согласованных по возрасту, полу, расе и госпиталю, в котором они были диагностированы. Детали метода, с помощью которого определялась категория профессии не были опубликованы, профессиональная история пациента не была собрана, за исключением названия текущей профессии, взятой из истории болезни. Несмотря на эти недостатки, Keller [55] наблюдал три статистически существенных различия: 8.3 % случаев саркоидоза имели профессию по сравнению с 3.8 % в контрольной группе; 3.8 % были продавцами, по сравнению с 1.2 % в контрольной группе, саркоидоз более редко наблюдался среди чернорабочих (17.1 % против 28.6 % в подгруппе чернокожих ветеранов; 14.3 % против 21.4 % во всей группе). Эти данные позволили предположить, что некоторые профессии могут быть связаны с увеличенным, а другие с уменьшенными риском саркоидоза. Факт, что чернорабочие, которые часто выполняют работу вне помещений и работу на множестве различных участков, имели более низкий риск саркоидоза (OR=0.5), снова поднял вопрос о связи внутренней среды производственных помещений и саркоидоза. В исследовании Buck с колл. [63- 66], авторы собрали данные о работе в лесозаготовительной промышленности и сельском хозяйстве и не обнаружили никаких различий между 62 случаями саркоидоза и контрольной группой. Кроме исследований Parkes [60] и Hills [79], показавших увеличенную частоту медсестер и работников здравоохранения среди пациентов с саркоидозом, Edmondstone [102] также наблюдал, что 24 из 156 случаев саркоидоза в Лондонской больнице были работниками больницы (15.4 %), включая 16 медсестр. Перепись населения 1981 г. показала, что только 1.6 % населения были медсестрами.
В исследование ACCESS [35] было привлечено 706 пациентов с недавно диагностированным, гистологически верифицированным саркоидозом из 10 медицинских центров США и контрольная группа, согласованная по возрасту, расе и полу. Анкетный опрос содержал вопросы относительно профессиональных и непрофессиональных воздействий, включая полную хронологию профессий и отраслей промышленности для каждого индивидуума, в которых он работал в течение 6 месяцев или более в любое время до постановки диагноза. Была собрана информация о характере воздействии, где оно произошло (дом, работа или и то и другое) и о продолжительности воздействия (более или менее 1 года). В исследование ACCESS [35] наблюдалась связь между саркоидозом и специфическими профессиями, включая сельскохозяйственные профессии, птицеводство, производство автомобилей, учителей средней школы и врачей. Обзор показал, что случаи контакта с птицами не были типичными случаями аллергического пневмонита. Предполагалось, что увеличенный риск у врачей мог быть идентифицирован ошибочно, из-за несогласованной контрольной группы для этой профессии. Воздействия, которые были положительно связаны с риском саркоидоза и включали использование инсектицидов на работе и контакт с почвой / плесенью, авторы ACCESS считают связанными с возможным воздействиям микробных биоаэрозолей. Мультипеременное моделирование показало увеличение OR для профессий, контактирующих с плесенью и инсектицидами, и уменьшение OR для тех, кто когда-либо курили сигареты. Это исследование не обнаружило единственного или преобладающего фактора риска для саркоидоза.
При всестороннем анализе случаев саркоидоза и контрольной группы в исследовании ACCESS с использованием стандартизированных кодов промышленности (SIC) и стандартизированных кодов профессий (SOC), Barnard с колл. [100] сообщили о положительной связи с некоторыми профессиями, включая занятость в розничной торговле строительными материалами, металлоизделиями, принадлежностями для сада и передвижными домами (профессии приведены согласно классификации SIC). Исследование показало, что работники этих профессий в три раза чаще имели саркоидоз, чем контрольная группа. Пациенты, сообщившие, что они работали в отраслях промышленности с воздействием индустриальной органической пыли (согласно классификации SIC), включая работу в промышленности, использующей аэрозольные растительные материалы (например, древесину) или на производстве текстиля, бумаги или сельскохозяйственной химии, также более вероятно имели саркоидоз, чем контрольная группа. Работа в начальной и средней школе (согласно классификации SIC) в качестве педагога (согласно классификации SOC), была положительно связана с саркоидозом. Интересно, что несколько отраслей промышленности и сферы обслуживания были отрицательно связаны с саркоидозом. Швейцары, коридорные, работники социальной помощи, няни (за исключением работающих в семьях) и работники службы доставки (согласно классификации SOC), были отрицательно связаны с саркоидозом. Работающие в отраслях промышленности, производящей электрическую энергию, в области социальных и реабилитационных услуг, в детских садах и яслях, менее вероятно имели саркоидоз, чем контрольная группа. SIC/SOC анализ в исследовании ACCESS также предполагает, что могут иметься различия в факторах риска саркоидоза в зависимости от расы и характера воздействия. Например, белые пациенты с саркоидозом более вероятно чем афро-американцы с саркоидозом работали в отраслях промышленности с воздействием металлической пыли, пара или индустриальной органической пыли [100].
Несколько иная задача решалась в исследовании Kreider с колл. [101] (исследование прооводилось в рамках ACCESS), в котором случаи саркоидоза были подразделены согласно клинического фенотипа. Выдвинув гипотезу, что различные клинические фенотипы саркоидоза могут быть связаны с различными воздействиями, Kreider с колл. [101] категоризировали 716 случаев саркоидоза в две группы: 1) только легочная болезнь (311 случаев, 43 %) и 2) системная болезнь (с или без поражения легких 407 случаев, 57 %). Из случаев системной болезни, 376 (92.3 %) имели поражение легкого в дополнение к поражению по крайней мере одного другого органа. Проводился анализ переменных местоположение / продолжительность для каждого воздействия, который включал местоположение (например, металлическая пыль на работе, дома или и то и другое) и продолжительность воздействия (например металлическая пыль, более или менее 1 года). Такие переменные были сформированы из-за опасения ошибочной классификации воздействий, что потенциально уменьшает способность анализа обнаружить реальные связи из-за включения в одну категорию пациентов с относительно незначительными воздействиями и с сильными и продолжительными воздействиями. Вся информация о воздействиях была собрана и категоризирована до определения поражения органов, таким образом устранив потенциальное информационное предубеждение.
Исследование Kreider с колл. [101] продемонстрировало, что воздействие продуктов горения древесины, сельскохозяйственной органической пыли или военная служба связаны с саркоидозом, который поражает только легкие. Число пациентов в категории военной службы было мало и, таким образом, в оценке риска может быть систематическая ошибка. Методологически, эта работа концептуально важна, потому что показала, что дифференцирование пациентов с саркоидозом на основании клинических фенотипов позволило обнаружить, что эти подгруппы могут иметь уникальные ассоциации с воздействием окружающей среды. Раса также может играть роль во влиянии некоторых воздействий на фенотип болезни.
Используя модифицированный анкетный опрос исследования ACCESS, Kucera с колл. [34] обнаружили положительные связи между случаями саркоидоза и некоторыми профессиями и отраслями промышленности для афро-американцев с саркоидозом по сравнению с родными братьями/сестрами пациентов без болезни. Хотя число случаев в категориях воздействия было мало, исследователи наблюдали, что индивидуумы, работавшие с металлом или местах с высокой влажностью, воздествием воды или плесенью (суггестивно для микробной среды) могут иметь увеличенный риск саркоидоза. Kucera с колл. [34] также отметили, что комплексность профессиональных воздействий делает трудным идентификацию специфического агента, опираясь только на название профессии. Следует отметить, что это критическое замечание применимо к большинству исследований эпидемиологии саркоидоза, проведенных до настоящего времени.
Используя анкетный опрос и дизайн исследования, аналогичные ACCESS, Kajdasz с колл. [59] провели анализ географического риска для госпитализаций афро-американцев с саркоидозом в штате Южная Каролина. С увеличенным риском саркоидоза было связано использование печей и каминов, которые топили дровами, нецентрализованное водоснабжение (например колодцы) и проживание или работа на ферме. Авторы предположили меньшее влияние работы в сельском хозяйстве и большую важность использования древесины для отопления [59].
В контексте других исследований, эти данные говорят, что исследование местных условий может позволить оценить различные триггерные механизмы этиологии саркоидоза.
Профессиональные кластеры саркоидоза
Множество исследователей саркоидоза идентифицировали кластеры болезни, которые предполагают возможную профессиональную связь. Stewart и Davidson [103] сообщили о кластере случаев саркоидоза у двух сестер и двух не связанных социальных контактов, включая работодателя одной сестры. Однако, это сообщение не идентифицировало никаких профессиональных факторов или факторов окружающей среды. Kern с колл. [104] сообщили о возникновении кластера из 3 случаев саркоидоза среди 57 пожарных, которые ранее вместе учились в Род-Айленде, США. Другие примеры профессиональных кластеров включают исследование пожарных Нью-Йорка (США) [105] и служащих Флота США в период 1971-1993 [106, 107]. Не известно, насколько часто профессиональные кластеры саркоидоза не обнаруживаются из-за недостаточного исследования связанных с профессией клинических симптомов, но исследование таких кластеров внесло важный вклад в понимание этиологии идиопатических болезней [108-110].
Эти исследования проиллюстрировали две важных концепции: 1) в некоторых случаях, индуцированные антигеном состояния ошибочно принимаются за саркоидоз; 2) воздействия окружающей среды могут вызывать саркоидоз.
Пример 1
Вспышка саркоидоза была идентифицирована на автомобильном производстве, где металлические части обрабатываются с использованием полусинтетического маслянного хладагента, называемого рабочей жидкостью [39, 111]. Клинически и патологически неразличимые от саркоидоза, все эти случаи были связаны с воздействием на рабочем месте. Такие жидкости для обработки металлов загрязняются разнообразными бактериями, включая микобактерии и эндотоксины [112, 113]. Аналогично, загрязненные бактериями водные источники могут производить аэрозоли, которые при попадании в организм ингаляционно, произодят саркоид-подобную болезнь [114-116]. Клинически, пациенты отвечают на устранение воздействия и кортикостероиды, но не на антимикробную терапию.
Пример 2
В 1979 г. у чернокожего мужчины, служащего компании, производящей ядерное оружие, развилась внутригрудная лимфаденопатия, диффузные узловые интерстициальные инфильтраты на рентгенограмме, было обнаружено увеличение ферментов печени и неказеозные гранулемы при биопсии легкого. Клинически и гистологически у него был диагностирован саркоидоз. Через 5 лет, с помощью исследования пролиферации лимфоцитов крови и бронхоальвеолярного лаважа в ответ на бериллий, болезнь пациента была признана случаем хронической бериллиевой болезни в компании, которая производила компоненты ядерного оружия. Это привело к систематическому исследованию завода и рабочих и открытию эндемической саркоид-подобной болезни вследствие воздействия бериллия на рабочих, участвующих в производстве ядерного оружия [117-123]. Некоторые из случаев хронической бериллиевой болезни в начале имели диагноз саркоидоз, что связано с сильным подобием этих двух состояний [124-126]. Ошибка начальной оценки в подобных случаях не удивительна и продолжает происходить во многих отраслях промышленности [127]. Например, Fireman с колл. [126] в Израиле опрашивали пациентов саркоидной клиники относительно контакта с металлами. У ответивших положительно было проведено исследование пролиферации лимфоцитов крови и клеток бронхоальвеолярного лаважа в ответ на бериллий. Приблизительно 6 % пациентов с ''саркоидозом'' на самом деле имели хроническую бериллиевую болезнь [126].
Пример 3
В марте 1989 г. у 24-летнего спасателя развился персистирующий кашель, затрудненность дыхания, прогрессирующая одышка при физической нагрузке, раздражение глаз и головная боль без лихорадки. Симптомы ухудшались в конце смены, сохранялись вечером, разрешались к следующему утру, но вновь возвращались. У пациента развилась гипоксемия и рентгенограмма показала диффузные интерстициальные помутнения, совместимые со стадией III саркоидоза. Исследование ЖБАЛ показало существенный CD4+ лимфоцитоз. Трансбронхиальная биопсия показала множественные неказеозные гранулемы, которые патолог классифицировал как совместимые с саркоидозом. Этот пациент стал одним из случаев эпидемии саркоид-подобной болезни, связанной с ингаляцией биоаэрозолей в плавательном бассейне, расположенном внутри помещения [128]. Бассейн имел много водных распылителей, которые произвели шестикратное увеличение объема воздушнокапельных частиц и восьмикратное увеличение уровней эндотоксинов в воздухе. Это позволило предположить, что водные распылители, возможно, производили антигенные биоаэрозоли [128]. В двух исследованиях, было идентифицировано 33 спасателя, имевших симптоматическую, подтвержденную биопсией гранулематозную болезнь легкого. В биоаэрозолях были найдены колонии грамм-отрицательных бактерий, преимущественно Pseudomonas spp., хотя остается некоторая неуверенность относительно фактического присутствия причинного агента саркоидоза в этой специфической окружающей среде. Это исследование демонстрирует, что болезни, которые являются клинически и патологически неразличимыми от саркоидоза, могут происходить в кластерах с обычным воздействием окружающей среды, как с временной группировкой, так и с пространственной. Подобные истории болезни ранее были описаны при микобактериальном загрязнении горячих бочек (hot tubs).
Пример 4
У пациента с профессиональным воздействием стекловолокна развилась саркоид-подобная болезнь [31]. Этот случай заставил Drent с колл. [32] рассмотреть истории болезни 50 пациентов с саркоидозом, иденифицированных в период 1996-1999 г. В 14 случаях, пациенты сообщили о профессиональной истории воздействия асбеста или стекловолокна или обоих материалов. В материалах 6 из 12 биопсий с помощью электронной микроскопии с дисперсионным рентгеновским микроанализом, было обнаружено множество веществ, включая кварц, алюминий и магний, которые являются элементами искусственных минеральных волокон. Скопления волокон были ассоциированы с гранулемами, что вело авторов к заключению, что эти волокна производят саркоид-подобный гранулематозный ответ.
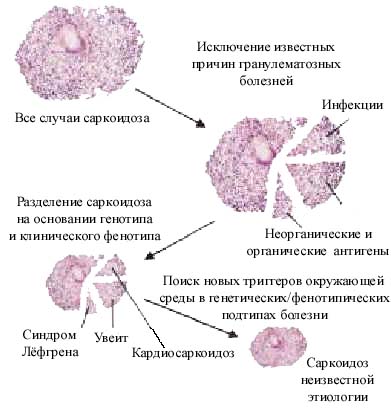
Следует отметить, что в каждом из этих четырех примеров, пациенты первоначально имели диагноз саркоидоз, основанный на патологическом исследовании материалов биопсии легкого или лимфатического узла и клинической оценки опытных врачей, наблюдавших этих больных. В этих случаях были выполнены текущие критерии для саркоидоза [5], включая неизвестную этиологию, так как исследователи пока не смогли идентифицировать этиологический агент или общее для всех пациентов воздействие. Такие случаи говорят, что когда клиницист подозревает саркоидоз, оценка пациента должна включать тщательное рассмотрение условий дома и на рабочем месте, включая оценку воздействий окружающей среды, эпидемиологическую оценку других индивидуумов и биологический контроль. В соответствии с моделью, предложенной в [129], неопределенность относительно этиологии саркоидоза может быть уменьшена, при идентификации известных причин гранулематозных болезней в окружающей среде или, по крайней мере, идентификации обстоятельств воздействия, что может позволить выдвинуть новые гипотезы относительно природы новых этиологических агентов саркоидоза (рис. 1).

Рис 1. Предполагаемая схема установления этиологии саркоидоза
Чтобы идентифицировать причину или причины саркоидоза, сначала нужно определить различия гранулематозных болезней известной этиологии от идиопатических. В настоящее время, некоторые случаи так называемого ''саркоидоза'' происходят вследствие воздействия известных агентов окружающей среды. Используя все доступные инструменты исследования, важно полностью исключить известные инфекционные агенты (например, микобактерии), органические антигены (например, термофилы и грибы, которые производят гранулематозный пневмонит) и неорганические антигены (например, бериллий и другие металлы). Если саркоидоз имеет более чем одну причину, а сама болезнь - это гетерогенная композиция болезней, следующим шагом должно быть выделение фенотипов. Уже сейчас является возможным клинически и генетически определить подгруппы ''саркоидоза''. Например, сейчас имеется вполне достаточное количество генетических, иммунологических, клинических данных, чтобы предположить, что синдром Лёфгрена является отдельной болезнью. То же самое можно было бы сказать для саркоидоза, который преимущественно проявляется увеитом, как это замечено в Японии и возможно для саркоидоза сердца. Выделение клинических фенотипов и генотипов, возможно, уменьшит гетерогенность саркоидоза и позволит более легко исследовать возможные агенты окружающей среды для каждого из отдельных состояний, вне зависимости от их природы.
Свидетельства микробной причины саркоидоза
В течение более ста лет, микробные патогены были основными подозреваемыми причинами саркоидоза. Поиск продолжается потому, что хотя ни один инфекционный агент не был культивирован из саркоидной ткани и не были обнаружены рРНК маркеры, некоторые клинические и эпидемиологические особенности саркоидоза предполагают инфекционную природу болезни. Например, имеются свидетельства заразности саркоидоза. Приобретенный от донора саркоидоз развивается у реципиентов, которые получили ткани или органы от доноров, у которых был диагностирован саркоидоз или подозревался активный саркоидоз [130, 131]. Также саркоидоз рецидивировал в аллотрансплантатах после трансплантации легкого [132]. Саркоид-подобные гранулемы развиваются у животных, которым пересаживали ткань от пациентов с саркоидозом [133-136]. Когда человеческая ткань, содержащая саркоидные гранулемы была гомогенизирована и затем введена мышам, гранулемы сформировались через 15 месяцев [137]. Этот эффект аннулировался при автоклавировании, замораживании до -20°C и воздействии радиации на саркоидную ткань.
Антиген Квейма, который является белковым экстрактом лимфатического узла или селезенки пациента с саркоидозом, производит олигоклональный T-клеточный ответ у пациентов с саркоидозом и производит гранулема-подобные кожные инфильтраты [138]. Дальнейшие исследования показали, что нежизнеспособные клетки ЖБАЛ, полученные от пациентов с саркоидозом, вызывали формирование гранулемы, когда вводились внутрикожно этим пациентам [139]. Хотя действующее начало антигена Квейма не было идентифицировано и было показано, что антиген Квейма не содержит бактериальной ДНК [140], в недавнем исследовании Song [7] в саркоидных тканях были обнаружены микобактериальные антигены (mKatG), что поддерживает микобактериальную этиологию. Саркоидные гранулемы были исследованы на наличие инородных компонентов и особенно на структуры, которые походят на микробные элементы. Организмы, структурно похожие на бактерии рода Leptospira, вызывающие лептоспироз, были идентифицированы при микроскопии ЖБАЛ пациентов с саркоидозом [141]. Подобные структуры были замечены в эпителиоидных клетках в пределах гранулем при саркоидозе и при семейной гранулематозной болезни [142, 143], хотя они имели сильное подобие с измененными тромбоцитами и не было доказано, что они являются инфекционными агентами [144]. Патологические структуры, замеченные при электронной микроскопии в клетках, ассоциированных с саркоидными гранулемами были идентифицированы как ''возможно микоплазма'' [145]. Недавно Eishi с колл. [9] при иммуногистохимической и электронномикроскопической экспертизе обнаружили окрашивание специфических антител к Propionibacterium spp. Таким образом, количество необычных ультраструктурных элементов, найденных в некоторых саркоидных гранулемах, постоянно увеличивается.
Дополнительную логичность предположению инфекционной причины саркоидоза придает факт, что другие гранулематозные болезни часто вызываются инфекционными организмами (Таблица 2). Они включают микобактерии, вирусы герпеса, трепонемы, шистосомы, возбудители споротрихоза, гистоплазмоза, коккцидиодомикоза, Listeria, Rhodococcus spp., Cladophialophora spp. и агент болезни Уиппла Tropheryma whippelii [146-151]. Эпидемиологические данные включают сообщения, предполагающие, что саркоидоз может происходить при контакте [60, 152] и в кластерах, подобному описаному Kern для пожарных [153]. Как было обсуждено ранее, эпидемиологические результаты исследования ACCESS предполагают, что окружающая среда, благоприятная для формирования биоаэрозолей, связана с увеличенным риском саркоидоза [35]. Профессиональное воздействие плесени также было связано с увеличенным риском саркоидоза. Большинство грибов производит летучие органические соединения в течение активного роста, с характерным запахом плесени [75, 154] и может отражать присутствие микроорганизма даже когда не имеется видимого роста [155, 156]. Кроме того, в исследовании ACCESS наблюдалось, что пациенты с саркоидозом более часто сообщают о наличии централизованного кондицинирования воздуха в доме. Несколько исследований также обнаружили, что симптомы были связаны с централизованным кондиционированием воздуха с или без увлажнения [75, 157, 158].
Результаты ACCESS, рассмотренные в контексте нескольких предыдущих исследований, также указывают на связь микробных биоаэрозолей с риском саркоидоза. Многие из микроорганизмов, которые были предположены как возможные причины саркоидоза, или болезней, походящих на саркоидоз, прекрасно растут в стоячей воде. Способность частиц аэрозоля содержать антиген и/или инфекционный агент могут приводить к их ингаляции, попаданию в легкие и иммунному ответу. В недавнем исследовании [59], связанные с саркоидозом госпитализации были сконцентрированы вблизи береговой линии штата Южная Каролина в США. Предыдущие исследования показали большую частоту саркоидоза в прибрежных государствах [41, 56, 57]. В исследовании Rose с колл. [128], спасатели, у которых развился гранулематозный пневмонит, были подвергнуты воздействию биоаэрозолей в бассейне, находящемся в центре досуга. В исследовании Kucera [34] наблюдалось, что родные братья/сестры с саркоидозом более вероятно сообщают о воздействии высокой влажности, воды или плесени, чем родные братья/сестры без болезни. Кроме того, кластеры гранулематозного пневмонита, походящего на саркоидоз, были описаны в связи с профессиональным воздействием при обработке металла с использованием загрязненной бактериями охлаждающей жидкости в автомобильной промышленности [159].
Микробные кандидаты включают микобактерии, человеческий вирус герпеса, ретровирусы, Chlamydia pneumoniae, Borrelia burgdorferi и Rickettsia Helvetica. Однако, никогда не было доказано, что один из этих агентов является причиной саркоидоза. Постулаты Коха не были выполнены, несмотря на серьезные усилия и интенсивное исследование микобактерий [8, 160]. Культуральные исследования и окрашивание саркоидных тканей не показало микобактерий, хотя два недавних исследования обнаружили микобактериальные антигены. Drake с колл. [8] обнаружили микобактериальные рРНК или rpoB последовательности в 60 % саркоидных тканей, но не в контрольной группе [8]. Song с колл. [7] идентифицировали микобактериальную mKatG и 16S rRNA в некоторых саркоидных тканях. Хотя эти исследования обнаружили 16s rRNA в пораженной ткани, эти результаты неокончательны, из-за ограничений дизайна, способа определения случаев саркоидоза, подбора контрольной группы, деталей методологии и невоспроизводимости результатов в других лабораториях, использующих подобные методы. Некоторые исследователи не смогли продемонстрировать микобактериальную ДНК в саркоидных повреждениях [160-166], принимая во внимание, что другие смогли обнаружить микобактериальную ДНК различных разновидностей [167-173].
Участие Propionibacterium spp. в развитии саркоидоза было предположено Eishi с колл. [9]. Первоначальное наблюдение состояло в том, что Propionibacterium acnes часто изолировались из тканей пациентов с саркоидозом [174]. Ishige с колл. [175] сообщили, что 15 из 15 образцов саркоидной ткани были положительны для пропионовых бактерий (P. acnes или P. granulosum) при рРНК ПЦР анализе, по сравнению с только 3 пациентами, положительными для микобактериальной ДНК; наоборот, 2 из 15 образцов ткани пациентов с туберкулезом были положительны для пропионибактерий и 15 из 15 положительны для микобактерий. Эти результаты были подтверждены в исследовании 259 пациентов из пяти центров Японии, Италии, Германии и Англии. ДНК пропионовых бактерий была обнаружена всего в 2 из 108 образцов ткани лимфатического узла пациентов с саркоидозом по сравнению ДНК M. tuberculosis, которая была обнаружена в 0-9 % образцов. ДНК пропионовых бактерий была обнаружена в 0-60 % образцов тканей пациентов с туберкулезом и контрольной группе [9]. Однако, Yamada с колл. [176] обнаружили, что при туберкулезе и саркоидозе 16S rRNA Proprionibacterium локализована прежде всего в областях вне гранулем. Эти результаты требуют подтверждения в независимых исследованиях.
Таким образом, хотя до настоящего времени для поиска причины саркоидоза использовались как традиционные методы, так и методы основанные на ПЦР, доказательств микробной причины саркоидоза было получено недостаточно. Генетический анализ является альтернативным методом идентификации предполагаемого инфекционного агента, когда гистологические и культуральные методы терпят неудачу. В принципе, подход основанный на ПЦР имеет большой потенциал для обнаружения инфекционных агентов в саркоидных гистологических препаратах. ПЦР использовалась, чтобы идентифицировать этиологические агенты бактериального ангиоматоза (Bartonella henselae) [177], болезни Уиппла (Tropheryma whippelii) [178] и продемонстрировала, что агент атипичной пневмонии является коронавирусом [179]. ПЦР имеет преимущество перед культивированием организма, так как ее чувствительность теоретически может приближаться к одной копии генома.
Превосходным примером генетического анализа пораженной ткани является обнаружение Tropheryma whippelii, агента болезни Уиппла. Гистологическая экспертиза ткани пациентов с болезнью Уиппла показала маленькие грамм-положительные палочки, которые наблюдаются как резистентные к диастазе интрацитоплазматические включения при окраске по Шиффу [180]. Культуральные исследования не позволили изолировать этот организм. ПЦР анализ был выполнен у пациентов с болезнью Уиппла [178], чтобы идентифицировать предлагаемый причинный агент болезни. Диагноз болезни Уиппла был подтвержден генетическим исследованием периферической крови [181] и в 2000 г. этот организм был культивирован из аортального клапана пациента с эндокардитом, вызванного Tropheryma whippelii [182]. В принципе, тот же самый подход должен использоваться при поиске микробного агента - ''святого грааля'' саркоидоза.
Концептуальные основы: от Коха до Бредфорда Хилла
Как было описано ранее, новые технологии, такие как генетические и иммунологические исследования, имеют большой потенциал для обнаружения причин саркоидоза. Однако, несмотря на этот потенциал, имеюся некоторые обстоятельства, которые препятствуют установлению этиологии саркоидоза.
Во-первых, имеются убедительные клинические, иммунологические и генетические причины считать, что саркоидоз - не одна болезнь, а скорее семейство болезней. Один из наиболее неотразимых примеров - острая форма саркоидоза - синдром Лёфгрена, при котором клинический фенотип, демография пациентов и генетические полиморфизмы человеческого лейкоцитарного антигена настоятельно предполагают, что этот синдром является отдельной болезнью, отличной от других хронических форм саркоидоза. Этот синдром может иметь общий патологический признак (гранулемы), но в остальном является весьма уникальным. Если саркоидоз - гетерогенное ''семейство'' гранулематозных болезней, усилия, направленные на обнаружение его единственной причины окажутся бесплодными, пока исследователи не сосредоточат этиологические исследования на тщательно подобранных подгруппах пациентов по клиническим, иммунологическим и генетическим признакам.
Во-вторых, даже если причина саркоидоза является микробной, механизм, ведущий к формированию гранулемы, может зависеть не от единственного организма, а скорее требовать взаимодействия более чем одного патологического фактора, например присутствия факторов, которые способствуют усилению врожденного иммунитета (свойства адъюванта) плюс присутствие антигена, который непосредственно мог бы иметь или не иметь микробное происхождение. В иммунологической литературе имеется вполне достаточное количество данных, чтобы предположить, что ''двойное попадание'', врожденный и приобретенный иммунитет, играют важную роль при саркоидозе [18]. Также возможно, что для развития болезни необходим более чем один организм, или возможно организм плюс эндогенный источник окружающей среды или адъювант.
В-третьих, наука регулярно бывает посрамлена разнообразием микробных агентов и относительной неосведомленностью относительно их числа и потенциального влияния на здоровье. Другими словами, если причина саркоидоза микробная, имеется возможность, что это может быть пока еще неоткрытый и неназванный организм. Еще более вероятной и сильной является возможность, что более чем один организм может быть способен вызывать саркоидоз. Литература по нетуберкулезным микобактериям регулярно сообщает о новых микобактериях, некоторые из которых: 1) способны вызывать некоторые формы гранулематозной болезни, например саркоид-подобную болезнь у рабочих, подвергнутых воздействию загрязненной охлаждающей жидкости, используемой при обработке металла; 2) пока не было установлено, что они способны причинять болезнь, но могут быть связаны с идиопатической болезнью.
В-четвертых, обнаружение генетического или иммунологического ''отпечатка пальца'' не обязательно доказывает этиологию. Если строго полагаться на постулаты Коха, то генетические исследования, включая поиск 16s rRNA, теряют доказательную силу в терминах этиологии. Постулаты Коха предусматривают, что организм должен быть изолирован у больного хозяина, его распределение в организме должно соответствовать наблюдаемым повреждениям, он должен быть выращен в чистой культуре вне организма хозяина и он должен воспроизводить характеристики болезни у других индивидуумов при введении чистой культуры. Постулаты Коха применимы только в том случае, если производится поиск инфекционного агента. Наука продолжает использовать иммунологию и генетику, чтобы сузить список ''подозреваемых'' микробных агентов и затем сосредоточить свое внимание на том, как выполняются постулаты Коха. Например, при болезни Уиппла, результаты ПЦР 16s rRNA позволили разработать специфические методы для культивирования и иммунологической маркировки актиномицет в ткани и крови индивидуумов с болезнью. Этот метод может быть плодотворным для саркоидоза, но в настоящее время, исследователи саркоидоза продолжают работать понимая, что не все организмы известны, не все могут быть изолированы или культивированы, что рост и пролиферация микроорганизмов не всегда могут быть необходимы для стимулирования формирования гранулемы и что причина саркоидоза может быть вовсе не микробной.
Если саркоидоз вызван не инфекцией, как исследователи могут устанавить причинную связь между фактором окружающей среды и болезнью? Очевидно, что в этом случае для установления этиологии нужно использовать другую парадигму, которая не предполагает, что все случаи болезни имеют инфекционную причину и не требует выполнения постулатов Коха. Этот вопрос обычно решается в области гигиены. Множество токсинов окружающей среды, от табачного дыма до бериллиевой пыли, были установлены как причины различных болезней без выполнения постулатов Коха. Исследователи саркоидоза могут получать выгоду при использовании этого подхода, сочетая инструменты эпидемиологии, иммунологии и генетики.
Концептуальный подход для установления причинной обусловленности для неинфекционных агентов окружающей среды был наиболее ясно сформулирован 40 лет назад Бредфордом Хиллом, в статье ''Окружающая среда и болезнь: ассоциация или причинная обусловленность'' [3]. Как показано в таблице 2, Бредфорд Хилл, профессор медицинской статистики Лондонского университета, описал девять ''точек зрения'', необходимых для изучения связи, ''прежде, чем мы начинаем кричать о причинной обусловленности''. Бредфорд Хилл указал, что, хотя эти девять ''точек зрения'' могут вносить вклад в способность установить причину болезни, ''ни одна из них может не требоваться как непременное условие''. Эти точки зрения с большей или меньшей силой могут помочь направить наши умы на решение фундаментального вопроса: имеется ли любой другой путь объяснения набора фактов, находящихся перед нами, имеется ли здесь какой-нибудь другой ответ, одинаково или более важный чем причина и следствие? По его мнению, проблема заключается в том, что исследователи не могут ''установить четкие правила, которых нужно придерживаться при установлении причинно-следственных связей''.
Таблица 2. Парадигмы установления этиологии
| Парадигма | Элемент | Ограничения и комментарии |
| Постулаты Генле-Коха | Изоляция инфекционного агента у носителя болезни | Возможности изоляции организмов ограничены. Много неизвестных организмов. |
| Культивирование вне тела хозяина в чистой культуре | Условия роста многих микроорганизмов неизвестны. | |
| Воспроизведение болезни у других организмов при введении чистой культуры | Микроорганизм должен вызывать гранулематозную болезнь вследствие своей антигенности, но не инфекции. Также, микроорганизм может быть ''эндогенным'' у наследственно восприимчивого индивидуума. | |
| Критерии Бредфорда Хилла | Сила связи | Большой относительный риск указывает на причинную связь. Однако, причинно-следственные отношения не могут быть исключены, даже если связь слабая. Необходимо установить, как часто воздействие происходит, но не производит болезнь. |
| Повторяемость | Повторное наблюдение связи между воздействием и развитием болезни: различными исследователями, в различных местах, обстоятельствах и в различное время. Наиболее благоприятно, когда результаты достигаются в иследованиях различного дизайна (например проспективных и ретроспективных). | |
| Специфичность | Необходимо показать, что воздействие связано с ограниченной группой индивидуумов, с особенностями окружающей среды, со специфическими клиническими фенотипами болезни и что не имеется связи между этим воздействием и другими болезнями. Некоторые агенты производят более чем одну болезнь. Болезни могут иметь более чем одну причину. Фактически, мультипричинная этиология может быть более обычной, чем единственная причина. | |
| Временная связь | Воздействие должно происходить до начала болезни. Проблематично для болезней, момент начала которых неизвестен. | |
| Биологический градиент | Зависимость доза-ответ для воздействия окружающей среды. Количественно измерить воздействие окружающей среды трудно. Необходимо знать интенсивность и продолжительность воздействия. Зависимость доза-ответ вероятно будет нелинейной. | |
| Правдоподобие | Биолологически правдоподобное объяснение, как даный агент может вызывать формирование гранулем. Не необходимо, но полезно при обосновании этиологии. Предполагается, что механизм и биологический эффект специфического воздействия известен и изучен. | |
| Когерентность | Данные не должны серьезно противоречить общеизвестным фактам естествознания и биологии болезней. | |
| Экспериментальное подтверждение | Удаление воздействия предотвращает или уменьшает частоту болезни. | |
| Аналогия | Подобие подозреваемого воздействия другим агентам, способным вызывать гранулематозную болезнь (например металлы, микобактерии) |
Некоторые из критериев Бредфорда Хилла в контексте исследования саркоидоза нуждаются в специальном комментарии, который поможет проиллюстрировать проблемы, которые возникают при определении причины саркоидоза. 1) Специчность ассоциации, потому что большинство патологий, рак, фиброз или гранулема, весьма вероятно имеют более чем одну причину. 2) Определение временной связи между воздействием и началом болезни для исследования саркоидоза проблематично, поскольку определить момент начала болезни можно только приблизительно. Саркоидоз может возникать внезапно или постепенно, однако, в любом случае, точное определение момента начала болезни отсутствует. Аналогично, многие воздействия, способные производить гранулематозные болезни, имеют широкий диапазон времени ожидания, от момента воздействия до начала болезни. Например, временной диапазон между первым воздействия бериллия и развитием хронической бериллиевой болезни располагается от 2 месяцев до более 40 лет. Аналогично, если подобная причина имеется для саркоидоза, воздействие могло бы произойти в любое время до начала болезни. 3) Критерий биологического градиента также проблематичен для болезней, подобных саркоидозу. Даже если знать причину саркоидоза, вероятно будет весьма трудно измерить степень предшествующего воздействия, которая привела к болезни. На это, вероятно, будет влиять генетическая восприимчивость хозяина и необходимо, чтобы увеличение иммунологической ''чувствительности'' произошло в момент времени, который предшествует началу болезни. Зависимость доза-ответ для антигена при иммунных болезнях, вероятно будет нелинейна. Таким образом, эпидемиологические исследования зависимости воздействие/болезнь для саркоидоза будут более сложными, чем для болезней, при которых эта зависимость является линейной.
К счастью, иммунологические свойства любого агента, который вызывает саркоидоз, позволит исследователям использовать критерий Бредфорда Хилла о большем преимуществе экспериментальных доказательств. В отличие от многих болезней, вызванных воздействиями окружаюшей среды, при саркоидозе является крайне необходимым экспериментально проверять предполагаемое воздействие на способность стимулировать болезнь-специфический антигенный ответ. Аналогично тому, как бериллиевый тест пролиферации лимфоцитов используется, чтобы доказать, что гранулематозная болезнь на самом деле является хронической бериллиевой болезнью, а не саркоидозом, любой агент, который предположительно вызывает саркоидоз, должен продемонстрировать антиген-специфический и болезнь-специфический ответ, антиген-специфический гуморальный ответ, антиген-специфическую пролиферацию лимфоцитов, производство цитокинов или реактивность кожной пробы. Эксперименты, которые проверяют антигенность микробных пептидов в чистом виде, или связанных с молекулами HLA антигенпрезентирующих саркоидных клеток, помогут проверить эту причинную связь экспериментально. Как предложил Бредфорд Хилл, для определения этиологии этой озадачивающей болезни, такие эксперименты должны быть объединены с другими восемью критериями.
Реферат
Причина или причины саркоидоза остаются неизвестными. Эта глава рассматривает некоторые из причин этой ситуации, обсуждает подходы, которые могут быть сформулированы при рассмотрении предыдущих исследований, рассматривает силы и слабости предложенных кандидатов, включая микроорганизмы и предлагает концептуальный подход для установления этиологии.
Ключевые слова: этиология, окружающая среда, саркоидоз.