The Proceedings of the American Thoracic Society 4:465-468 (2007)
Потенциальные этиологические агенты саркоидоза
David R. Moller
Division of Pulmonary and Critical Care Medicine, Department of Medicine, Johns Hopkins University, Baltimore, Maryland
Реферат
Этиология саркоидоза остается неизвестной. Признак саркоидоза - эпителиоидная гранулема, служит необходимой отправной точкой для рассмотрения этиологии болезни. Любой этиологический агент саркоидоза должен объяснить клиническое поведение и иммунопатологические особенности болезни. Клиническое наблюдение, которое служит мостом к этиологии саркоидоза - реакция Квейма. При этой реакции, эпителиоидные гранулемы развиваются через несколько недель в месте внутрикожной инъекции гомогената саркоидной ткани. Наша группа, опираясь на известные свойства реактива Квейма, пыталась найти кандидата в патогенные тканевые антигены при саркоидозе, без других априорных гипотез относительно возможных микробных или аутоиммуннных этиологий. Используя подход, основанный на физико-химических свойствах реактива Квейма, с помощью иммуноблоттинга мы обнаружили ограниченное число слабо растворимых антигенных белков в саркоидных тканях. Лазерная спектрометрия позволила идентифицировать один из этих антигенов, который является микобактериальной каталазой-пероксидазой (mKatG). Мы обнаружили IgG ответ на рекомбинантную mKatG более чем у 50 % пациентов с саркоидозом, причем ответ был редким в группе контроля у индивидуумов с отрицательной реакцией на туберкулин. Эти результаты поддерживают предположение, что mKatG является тканевым антигеном и целью адаптивного иммунного ответа при саркоидозе, обеспечивая дальнейшие свидетельства микобактериальной этиологии в подгруппе пациентов с саркоидозом. Подход, используемый в этом исследовании, может быть полезен для обнаружения других патогенных антигенов при саркоидозе и других гранулематозных болезнях.
Введение
Так как саркоидоз впервые был описан приблизительно в 1900 г., причина болезни была предметом большого числа исследований и дискуссий. Пространственно-временные кластеры болезни и семейная группировка поддерживают гипотезу триггера окружающей среды, но не позволяют определить специфическую причину саркоидоза. Микробные этиологии саркоидоза всегда рассматривались на основании клинического подобия с инфекционными гранулематозными болезнями (1). Микобактериальные и пропионибактериальные организмы наиболее часто предлагались как потенциальные этиологические агенты в исследованиях, использующих полимеразную цепную реакцию, которые сообщали об обнаружении ДНК этих организмов в тканях пациентов с саркоидозом во всем мире (2, 3). Однако, результаты различных исследований значительно различались между собой, кроме того сообщалось об обнаружении микробной ДНК в 0-80 % образцов саркоидной ткани, а также в 0-30 % тканей группы контроля (4, 5). В исследовании ACCESS были получены даные, которые указывают на возможную связь болезни с микробной окружающей средой (6). Однако, риск развития болезни для микробных агентов был небольшим (OR приблизительно 1.5) и ложноположительные связи не могли быть исключены. В целом, эти исследования не позволили достичь согласия о роли специфического микробного агента как причины саркоидоза. Остается определенная неуверенность относительно роли аутоиммунных процессов в патогенезе саркоидоза, хотя этот механизм также может быть связан с микробными триггерами. Однако, до настоящего времени, аутоантигенов, специфически связанных с саркоидозом, обнаружено не было. Данные, что генетические факторы, особенно гены главного комплекса тканевой совместимости, играют роль в восприимчивости к саркоидозу, могут быть совместимы с микробной или аутоиммуннной природой саркоидоза, но не позволяют идентифицировать специфическую этиологию (7, 8).
Фундаментальные особенности саркоидоза
Несмотря на неизвестную этиологию, обзор фундаментальных особенностей саркоидоза может быть полезной отправной точкой для дальнейших исследований. Для саркоидоза, отправной и конечной точкой является гранулема. Формирование гранулем - сохранившийся с древности патологический ответ, обычно на инородный материал, происходит вокруг очагов слабо растворимого или нерастворимого материала, который не может быть удален одним типом клеток. Гранулема - четко организованная структура, с участием различных клеток, которая развивается в течение от нескольких дней до нескольких недель. В усилении иммунного ответа, которое происходит вследствие антигенного возбуждения на участках формирования гранулемы, могут участвовать клетки Т-хелперы, типа Th1 или Th2 (9). При саркоидозе, гранулематозное воспаление изменяет местный тканевый гомеостаз, что приводит к ухудшению функции пораженного органа. Учитывая, что эпителиоидная гранулема - патологический признак саркоидоза, любой предполагаемый этиологический агент должен быть способен стимулировать этот паттерн воспаления.
Любой этиологический агент саркоидоза также должен объяснять характерное клиническое поведение болезни (10). Фундаментальные клинические особенности, обнаруженные у большинства пациентов, включают прогрессирующий клинический курс начального гранулематозного воспаления, если не происходит ремиссии (исключение - поражение глаз или нервной системы а также узловатая эритема); ремиссию или хронический клинический курс; редкость рецидива после ремиссии; множественное поражение органов; переменную степень прогресса гранулематозного воспаления у различных индивидуумов и в различных органах; подавление гранулематозного воспаления противовоспалительной терапией, которая не излечивает саркоидоз; редкость оппортунистических инфекций, подразумевающая отсутствие системного ухудшения иммунной защиты хозяина. Хотя имеются некоторые пациенты с саркоидозом, с клиническим курсом, лежащим вне этих типичных параметров, необходимо чтобы любой этиологический агент саркоидоза был способен стимулировать патологический процесс, совместимый с этими основными клиническими особенностями.
Кроме того, любой этиологический агент саркоидоза должен быть способен воспроизводить характереные иммунопатологические особенности болезни (11). Эти особенности включают: доминирование CD4+ T-клеток на участках гранулематозного воспаления; олигоклональность T-клеток, экспрессирующих специфические гены Т-клеточного рецептора, что совместимо с управляемым антигеном иммунным ответом; поляризованную экспрессию Th1 цитокинов во время постановки диагноза (при фиброзе поляризация цитокинов точно не известна); ''классически активизированный'' фенотип макрофагов во время постановки диагноза; усиление экспрессии фактора некроза опухоли и других цитокинов и хемокинов, участвующих в развитии экспериментального гранулематозного воспаления. Эти иммунопатологические особенности саркоидоза, дают второй важный ряд критериев для исследования кандидатов в этиологические агенты саркоидоза.
Реакция Квейма
В пределах описанного клинического и иммунопатологического базиса, сушествует клиническое наблюдение, которое может служить мостом к этиологии саркоидоза - реакция Квейма-Зильцбаха или реакция Квейма. Реакция Квейма первоначально наблюдалась как местная, узловая сыпь через несколько недель после внутрикожной инъекции гомогенатов изогенного или аллогенного лимфатического узла или ткани селезенки пациента с саркоидозом. Ансгаар Квейм в 1940-х годах первый сообщил, что биопсия этих узелков демонстрировала присутствие эпителиоидных гранулем, которые были гистологически идентичны гранулемам, замеченным в других тканях при саркоидозе (12). В отличие от аллергической реакции задержанного типа, развитие эпителиоидных гранулем при этой реакции происходит через много дней, с развитием ''правильно'' построенных гранулем через 2-4 недели или более. Луи Зильцбах и другие исследователи продемонстрировали, что приблизительно 80 % пациентов с саркоидозом во всем мире имеют положительную реакцию (гранулемы) на стандартизованный реактив Квейма, с менее чем 1 % ложноположительных реакций в группе контроля (13). Более современные исследования показали, что реакция Квейма характеризуется притоком CD4+ T-клеток и гистиоцитов, с олигоклональной экспансией специфических T-клеток, что совместимо с антиген-специфическим иммунным ответом (14). Физико-химические свойства компонента реактива Квейма, стимулирующего развитие гранулем, были определены в исследованиях in vivo у пациентов с саркоидозом. Эти свойства включают: относительную резистентность к нейтральным детергентам, высокой температуре, кислоте, органическим растворителям, нуклеазам и протеазам (15, 16). Факт, что действие реактива Квейма аннулируется мощными денатурирующими средствами, предполагает, что активный компонент реактива Квейма имеет белковую природу (17). Эти физико-химические свойства, возможно, отражают характеристики агента, который вызывает развитие гранулем у пациентов с саркоидозом.
Поиск Квейм-подобных антигенов
Подход для идентификации патобиологически уместных антигенов при саркоидозе, может быть построен на физико-химических свойствах гранулемогенного компонента реактива Квейма. В этом контексте, наша группа использовала подобный подход, ограничив поиск тканевых антигенов при саркоидозе, антигенами с биохимическими свойствами, подобными свойствам реактива Квейма (18). Мы выдвинули гипотезу, что саркоидоз вызван T- и B-клеточным ответом на слабо растворимые белковые структуры микробного и/или эндогенного происхождения с физико-химическими свойствами, подобными свойствам реактива Квейма. Этот подход позволил отказаться от априорных гипотез относительно природы специфических агентов или аутоантигенов.
Схема нашего подхода:
Чтобы сконцентрировать тканевые антигены со свойствами, подобными антигенам реактива Квейма, мы использовали два различных подхода. Во-первых, была разработана процедура извлечения, чтобы сконцентрировать резистентные к протеазе тканевые белки, которые были нерастворимы в нейтральном детергенте. Во-вторых, предположив, что саркоидные антигены формируют слабо растворимые скопления, мы использовали адаптированый метод концентрации прионных или амилоидных белков (19). Эти два метода позволили отделить более 90-99 % начальной массы замороженной ткани. После экстракции из саркоидных тканей и тканей группы контроля, с помощью иммуноблоттинга производился поиск потенциальных тканевых антигенов. С помощью обоих методов, мы обнаружили дискретные антигенные полосы при иммуноблоттинге с циркулирующими фрагментами IgG или Fab у пациентов с саркоидозом, но не в группе контроля (18). Эти результаты указывают, что в саркоидных тканях существуют слабо растворимые антигены.
Микобактериальная каталаза-пероксидаза как кандидат в патогенный антиген
Чтобы идентифицировать эти неизвестные антигены, мы использовали лазерную спектрометрию и метод фингерпринтов (метод генетических ''отпечатков пальцев'') (18). Наши первые результаты показали статистически значимое соответствие спектра массы антигена с каталазой-пероксидазой Mycobacterium tuberculosis (mKatG) (18). Анализ образцов ткани легкого пациентов с саркоидозом, также показал потенциальное совпадение (статистически не значимое) с каталазой-пероксидазой Mycobacterium smegmatis. Чтобы подтвердить присутствие mKatG в саркоидных тканях, мы использовали иммуноблоттинг и специфические моноклональные антитела к mKatG (IT42, предоставлены Colorado State University, Fort Collins, CO, по контракту с NIH). При этом подходе, мы обнаружили присутствие mKatG в 55 % образцов саркоидных тканей, но не в тканях группы контроля. Мы также подтвердили присутствие ДНК микобактериальной katG в саркоидных тканях, используя in situ гибридизацию (18). Поскольку роль этого специфического микобактериального белка ранее не рассматривалась ни в одном исследовании саркоидоза, эти результаты, возможно, позволят использовать этот подход для идентификации новых кандидатов в патогенные антигены при саркоидозе.
Микобактериальная KatG хорошо известна клиницистам, потому что приблизительно 80 % резистентных к изониазиду случаев туберкулеза, связано с инактивной или мутантной формой katG (20). Изониазид - препарат, который имеет микобактерицидную активность, действуя на KatG. Микобактериальная KatG - содержащий гем фермент широкого действия, с активностью каталазы и пероксидазы. Этот белок - вирулентный фактор, позволяющий Mycobacterium tuberculosis длительно находитться внутри макрофагов. У многих микобактериальных разновидностей, KatG - гомодимер, массой приблизительно 80 kD. Иммунный ответ на mKatG был обнаружен у пациентов с туберкулезом, хотя роль этого белка в защите хозяина против Mycobacterium tuberculosis остается неизвестной.
Обнаружение, что mKatG является тканевым антигеном и целью адаптивного иммунного ответа при саркоидозе, имеет как специфическое, так и общее значение для возможных этиологий саркоидоза. Присутствие микобактериальной KatG и ДНК katG в саркоидных тканях - свидетельство микобактериальной этиологии болезни, по крайней мере в подгруппе пациентов с саркоидозом. Более того, наши результаты доказывают, что саркоидная гранулема содержит патобиологический материал, который может указывать на этиологию саркоидоза. Эти результаты не исключают возможность, что другие микробные организмы, например Propionibacterium acnes, могут быть этиологическими агентами в других подгруппах пациентов с саркоидозом (4). В этом контексте, присутствие микобактериальной или микробной ДНК в саркоидных тканях, лишь одна форма этиологического маркера. Чтобы подтвердить этиологическую роль любого специфического микробного агента, необходимо идентифицировать ту часть микробных антигенов в саркоидных тканях, которая является ответственной за стимулирование T- и B-клеточного ответа, участвующего в местном гранулематозном воспалении.
Идентификация mKatG как кандидата в патогенные антигены при саркоидозе, поднимает несколько очевидных вопросов. Является ли ответ на mKatG основным патогенным или дополнительным маркером воспаления? Имеет ли mKatG доминирующую роль, или это один из многих микобактериальных антигенов, участвующих в развитии саркоидоза? Имеют ли mKatG-специфические T-клетки эффекторный или регулирующий фенотип? Эти фенотипы различаются при спонтанной ремиссии и хроническом саркоидозе? И наконец, учитывая, что присутствие mKatG указывает на предшествующую микобактериальную инфекцию, в чем заключается различие между саркоидозом и активной / латентной микобактериальной инфекцией?
Чтобы ответить на эти вопросы, сначала необходимо охарактеризовать mKatG-специфические T-клетки и коррелировать результаты исследования T- и B-клеточного ответа с клиническими фенотипами саркоидоза. Сравнение туберкулин-положительных и туберкулин-отрицательных индивидуумов, после вакцинации БЦЖ и инфекции Mycobacterium tuberculosis, могут дать данные, позволяющие различить иммунный ответ при саркоидозе и микобактериальной инфекции. Имеет ли mKatG особые свойства, приводящие к формированию гранулемы, может быть исследовано на животных моделях. В зависимости от результатов этих исследований, mKatG может быть использована как диагностический тест или как часть стратегии вакцинации для лечения саркоидоза. Хотя другие тканевые антигены также вероятно участвуют в развитии саркоидоза, обнаружение специфического кандидата в патогенные антигены, по крайней мере обеспечивает возможность исследовать патобиологический процесс, который определяет иммунологический ответ при саркоидозе.
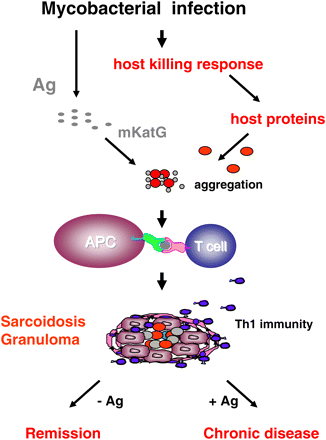
Хотя не известно, какие специфические свойства mKatG вносят вклад в ее персистирование в саркоидных тканях, вероятно, mKatG не является единственным компонентом любого очага развития эпителиоидной гранулемы. Очаги формирования саркидных гранулем, вероятно, содержат другие белки хозяина и также могут включать другие микробные белки. Мы предполагаем, что эти белки, вместе с mKatG, формируют слабо растворимые белковые скопления, которые являются очагами формирования гранулемы и источниками антигенного материала (рис. 1). В рамках полученных результатов, мы предлагаем обновленную гипотезу потенциального этиологического агента саркоидоза.
Гипотеза
Саркоидоз вызвается эффективным антимикробным ответом хозяина на микобактериальную инфекцию, которая приводит к формированию депозитов микобактериальных антигенов и белков хозяина, которые формируют очаги для формирования гранулем, что вызывает патогенный Th1 ответ, который разрешается только при эффективном удалении стимулирующих антигенов.

Рис 1. Гипотетическая модель микобактериальной этиологии саркоидоза. Латентная микобактериальная инфекция приводит к производству микобактериальных антигенов (Ag), которые стимулируют микобактерицидный ответ хозяина. При саркоидозе, белки хозяина индуцированные как часть этого ответа, соединяются с mKatG и формируют слабо растворимые очаги, которые являются источником микробных антигенов и центрами для формирования гранулем. Макрофаги и дендритные клетки (антиген-презентирующие клетки), непосредственно активизированные скоплениями белков хозяина и mKatG, производят Th1 цитокины, IL-12, IL-18 и фактор некроза опухоли. Антиген-специфический Th1 ответ запускает сложный процесс формирования эпителиоидных гранулем и воспаления. Удаление антигенных скоплений, вместе с иммуносупрессивным действием трансформирующего фактора роста бета, приводит к регрессу гранулем и ремиссии болезни. Если удаления скоплений белков хозяина и mKatG не происходит, это приводит к индукции аутоиммунных процессов, персистирующего воспаления и хронической болезни.