
Eur Respir J 2000; 16: 768-780
Генетические аспекты саркоидоза
M. Luisetti, A. Beretta, L. Casali
Clinica di Malattie dell'Apparato Respiratorio, IRCCS Policlinico San Matteo, Universita di Pavia, and Cattedra di Malattie dell'Apparato Respiratorio, Universita di Perugia, Italy.
Реферат
Саркоидоз - мультиорганная, гранулематозная болезнь, которая может быть вызвана сложной комбинацией генетических факторов и факторов окружающей среды. Поддерживают гипотезу наличия генетического компонента в патогенезе саркоидоза расовые различия в эпидемиологии и семейная группировка случаев болезни. Рассмотрены связь между эпидемиологией и факторами окружающей среды, влияющими на различия в заболеваемости / распространенности саркоидоза а также стратегии, которые нужно использовать в поиске генов восприимчивости к саркоидозу.
Процессы, ведущие к формированию саркоидной гранулемы побудили исследователей, заинтересованных генетикой саркоидоза, в первую очередь сосредоточиться на генах главного комплекса тканевой совместимости. В отличие от некоторых аутоиммуннных болезней, явная связь между человеческим лейкоцитарным антигеном (HLA) и саркоидозом все еще остается спорной. Однако, имеется общее согласие, что некоторые гены HLA связаны с фенотипическими разновидностями болезни. Некоторые исследователи сосредоточились на генах T-клеточного рецептора, генах иммуноглобулина, гена ангиотензинпревращающего фермента, генах хемокинов и других генах.
При обзоре исследований, выполненных в различных расовых и этнических группах, возникает разумное предложение, что генетические факторы - главные детерминанты расовых вариаций эпидемиологии болезни. Это предположение, однако, ограничено малым числом исследований, рассматривающих генетические факторы и факторы окружающей среды одновременно.
Саркоидоз - мультиорганная болезнь неизвестного происхождения, характеризованная присутствием неказеозных гранулем [1]. Самый ранний шаг в иммунологических событиях, ведущих к формированию гранулемы - накопление T-лимфоцитов и мононуклеарных фагоцитов в вовлеченных органах. Активизированые CD45R0+VE клетки T-хелпер 1 (Th1), являются самыми важными в этой инфильтрации.
Этот феномен на участках воспаления регулируется двумя механизмами: экспансией CD4+VE клеток памяти после их перераспределения из кровотока под влиянием нескольких хемокинов, и in situ пролиферацией под действием интерлейкина-2 (IL-2) [2-4]. Иначе говоря, формирование гранулемы при саркоидозе, происходит при Th1 ответе T-клеток. Этот путь возникновения саркоидоза, хотя чрезвычайно упрощен, является результатом существенного прогресса в понимании патогенеза болезни, сделанного в течение последних двух десятилетий. Эта особенность является общей с многими другими легочными болезнями, такими как астма, хроническая обструктивная болезнь легкого (ХОБЛ), идиопатический легочный фиброз (IPF), первичная легочная гипертония, легочно-альвеолярный протеиноз. При исследовании всех этих болезней биохимия, биология клеток и методы молекулярной биологии позволили достичь крупных достижений в понимании патогенеза саркоидоза.
Эти состояния, подобно саркоидозу, являются болезнями, вызванными сложной комбинацией факторов окружающей среды (известных в некоторых случаях, но неизвестных в других) и генетических (в значительной степени неизвестных) факторов [5]. С этой точки зрения, они могут быть определены как полигенные болезни, в отличие от болезней вследствие мутации единственного гена (моногенные или Менделевские болезни), такие как дефицит aльфа1-антитрипсина или муковисцидоз. Текущая проблема при исследовании сложнх болезней - разъяснение генетических механизмов и идентификация генов восприимчивости [5]. Генетическую восприимчивость к саркоидозу можно предположить из-за наличия расовых и, в меньшей степени, этнических вариаций заболеваемости саркоидоза и семейной группировки болезни [6]. Однако, этиология саркоидоза остается неизвестной.
Поэтому, не может быть исключена возможность, что расовая вариабельность может быть следствием различия рисков воздействующих факторов окружающей среды. Кроме того, семьи имеют не только общие гены, но общую окружающую среду. В этом контексте, генетические исследования саркоидоза проводились на менее благоприятном фоне, чем другие сложные болезни, такие как ХОБЛ или хроническая бериллиевая болезнь, для которых знание главных детерминантов окружающей среды позволило произвести лучшее определение фенотипов [7, 8]. Однако, исследования генетики саркоидоза позволили накопить достаточно данных, подтверждающих, что некоторые генетические факторы влияют на изменение фенотипа болезни, то есть, клинической экспрессии болезни [4]. Пока остается необъясненным, как эти факторы изменяют фенотип болезни и, что возможно более интересно, влияют ли эти генетические факторы на восприимчивость к саркоидозу [4].
Роль взаимодействия генетических факторов и факторов окружающей среды в развитии саркоидоза практически не исследована. В исследовании ACCESS было зарегистрировано 720 недавно диагностированных пациентов в саркоидозом, которые были сравнены с согласованной по возрасту, полу и расе группой контроля. Это исследование имело потенциал, чтобы проверить различные этиологические гипотезы или, по крайней мере, выдвинуть новые гипотезы [9].
Эта статья рассматривает текущие знания о генетических аспектах саркоидоза.
Связь между генетическими факторами и факторами окружающей среды, влияющими на эпидемиологию саркоидоза
Расовые и этнические вариации эпидемиологии саркоидоза
Саркоидоз происходит во всем мире и в обоих полах, но о небольшом преобладании женщин было сообщено во многих рядах пациентов [1]. Саркоидоз могут иметь люди всех возрастов, но болезнь обычно воздействует на молодых взрослых (20-40 лет), со вторым возрастным пиком у женщин > 50 лет в Японии и Скандинавии [10, 11].
Болезнь распределена среди всех рас и этнических групп, но со значительными вариациями. Распространенность болезни располагается от ~50 на 100,000 жителей (Швеция, Дания, чернокожие в США) до < 1 на 100,000 (Испания, Португалия, Италия, Саудовская Аравия, Индия) [12]. В исследовании населения Рочестера, штат Mиннесота, США, заболеваемость была 5.9 на 100,000 в год у мужчин и 6.3 у женщин [13], принимая во внимание, что ежегодная заболеваемость во всех расах на северо-западе США была оценена в 4.8 на 100,000 [14]. В сравнительном исследовании, распространенность саркоидоза в Финляндии составляла 28.2 на 100,00 и 3.7 на 100,000 в Японии (Хоккайдо) [15]. Исследования в гомогенных областях показали значительные расовые вариации. Исследование 1,216, 425 служащих флота США в период 1958-1969 г. показало, что саркоидоз воздействовал на чернокожих в 10-17 раз более часто, чем на белых [16]. В Детройте, ежегодная заболеваемость составляет 36.3 на 100,000 среди афро-американцев и 11.3 на 100,000 среди белых [17]. В Нью-Йорке, распространенность саркоидоза составляет > 50 на 100,000 среди афро-американцев, 40-20 среди пуэрториканцев /испанцев и 10-20 у белых [12, 18].
Значительное количество данных говорит, что фенотип саркоидоза, то есть проявления и серьезность болезни, изменяются в зависимости от расовых и этнических факторов. Большая серьезность болезни у афро-американцев и более частая бессимптомная болезнь у белых общепризнаны [4]. Белые имеют узловатую эритему более часто чем японцы [19] и реже внелегочное вовлечение, чем афро-американцы и японцы [10], принимая во внимание, что частота кардиосаркоидоза выше среди японцев, чем среди белых и афро-американцев [10]. В сравнительном исследовании 107 пациентов из северной Италии и 126 чешских пациентов с саркоидозом, были обнаружены этнические вариации: 58 % чешских пациентов против 35 % итальянцев имели рентгенологическую стадию I, принимая во внимание, что только 7 % имели стадию III, против 23 % итальянцев; болезнь была более продолжительной у итальянцев чем у чехов (39 против 22 месяцев) [20].
Смертность является подобной среди различных рас [1]. Однако, исследование саркоидоза или смертности от его осложнений в США в период 1979-1991 г. показало более высокую смертность среди афро-американцев, чем среди белых [21]. Эти данные поддерживают концепцию, что раса и этническая принадлежность влияют на распространенность / заболеваемость и паттерн болезни. Наиболее очевидный вывод, который может быть сделан из вышеупомянутых данных, то, что такие вариации связаны с генетическими факторами. Однако, на эпидемиологические данные могут влиять различные факторы, такие как факторы окружающей среды (которые могут зависеть от расы и, в меньшей степени, этнической принадлежности), различия в методах диагностирования саркоидоза (что может вести к пропуску или ошибочному диагнозу болезни) и проблем в регистрации саркоидоза.
Факторы окружающей среды
Причина(ы) саркоидоза остаются неизвестными. Однако, сообщения о вспышках саркоидоза в некоторых группах населения, группах профессионального риска и о простанственно-временной группировке болезни, предполагают возможность, что саркоидоз вызван общим фактором окружающей среды [1]. Однако, важно отметить, что это предположение остается недоказанным, не только из-за отсутствия данных о природе предполагаемого агента, но также и из-за невоспроизводимости результатов некоторых исследований или серьезных ошибок в других [22].
Некоторые результаты предполагают возможную роль факторов окружающей среды в патогенезе саркоидоза. 1) Сообщения о временной группировке саркоидоза у членов семьи без родственных связей [23]. 2) Несколько отчетов сообщили о высоком риске саркоидоза (или ''саркоид-подобной'' болезни) у медсестер, пожарных и работающих с алюминией или цирконием [1]. 10-летнее наблюдение пожарных Нью-Йоркского отдела пожарной охраны (NYFD), показало распространенность саркоидоза 222 на 100,000 [24]. Следует отметить, что саркоидоз был отмечен всего у 6 % не белых пожарных NYFD, в отличие 42 % группы контроля, таким образом исключая возможный эффект расовой вариации. 3) Сезонность возникновения саркоидоза была описана в обоих полушариях [25]. Кроме того, сообщалось о влиянии климата и на распространенность и проявления болезни в Японии [26]. 4) Возникновение внелегочного саркоидоза после трансплантации легкого и возможная передача болезни при аллогенной трансплантации костного мозга [27] поддерживает гипотезу передающегося агента.
Возможно, наиболее важное исследование в этой области - исследование 96 пациентов с саркоидозом диагностированных в период 1962-1983 г. на острове Мэн [28, 29]. Высокая частота контактов (~40 %) среди пациентов с саркоидозом и сильная связь между случаями, разделенными интервалами времени < 10 лет и расстоянием < 100 м. (пространственно-временная группировка), является самым сильным доводом, поддерживающим гипотезу, что неизвестный передающееся агент вызывает саркоидоз [1]. Однако, как указал Rybicki [6], исследование саркоидоза на острове Мэн также указывают на генетические факторы, которые могли играть роль в этой группировке: фактически, имелись 9 случаев семейного саркоидоза, но ни одного случая болезни у членов семьи без родственных связей. Кроме того, процент родственных браков у пациентов с саркоидозом был выше, чем ожидалось.
Помимо неорганических или органических агентов, известно, что многие инфекционные агенты, включая вирусы, Borrelia burgdorferi, Propionibacterium acnes, микобактерии и микоплазма, способны вызывать гранулематозный ответ, характерный для саркоидоза [3, 4]. Однако, несмотря на интригующие результаты, попытки воспроизвести или изолировать любой агент или создать животную модель саркоидоза потерпели неудачу, что поддерживает гипотезу, что инфекционный агент лежит в основе саркоидоза [4]. Однако, результаты, полученные при поиске микобактериальной ДНК в саркоидных тканях не исключают возможную роль этих агентов, по крайней мере в некоторых группах пациентов с саркоидозом [30]. Эта концепция удовлетворяет факту олигоклональности болезни [3]; другими словами, активация олигоклональных T-клеток может являться ответом на ''неуловимый агент саркоидоза''.
В заключение отметим, что хотя существуют данные, предполагающие, что факторы окружающей среды могут вызывать саркоидоз, недостаточная статистическая мощность исследований, и факт, что взаимодействие факторов окружающей среды с генетическими факторами никогда не изучалось, возможно, существенно влияли на результаты многих из этих исследований [6].
Объясняют ли факторы окружающей среды расовые и этнические вариации эпидемиологии саркоидоза?
Как было упомянуто выше, генетические факторы, вероятно, объясняют расовые и этнические вариации эпидемиологии саркоидоза. Однако, отсутствие однозначной идентификации фактора окружающей среды, не может исключать, что факторы окружающей среды могли бы объяснять такие вариации. В качестве примера можно привести поразительные различия между заболеваемостью саркоидозом у коренных Лондонцев (27 на 100,000) и Ирландских иммигрантов, живущих на севере Лондона (97 на 100,000) [12]. Интересно, что флюорографический скрининг в Ирландии показал заболеваемость 33 на 100,000 [31], что не отличается от заболеваемости у коренных Лондонцев. Хотя существуют некоторые различия между этими двумя исследованиями, например, различия по возрасту, такая большая разница в двух этнически гомогенных популяциях предлагает роль фактора (ов), к которому Ирландские иммигранты являются более восприимчивыми, чем коренные Лондонцы [12]. Однако, отсутствие информации, большие различия в методах скрининга и социально-экономическом статусе, делает невозможным подтверждение этой гипотезы в других частях мира.
Семейная группировка саркоидоза
Сообщалось о нескольких сотнях случаев семейного саркоидоза во всем мире [32]. Существование кластеров саркоидоза в семьях, рассматривается как самое сильное свидетельство существования генетического компонента саркоидоза [6]. Первое крупное сообщение о семейном саркоидозе было опубликовано в 1973 г. Research Committee of the British Thoracic and Tuberculosis Association [33], где был описан 121 пациент в 59 семьях. Интересно, что это исследование показало преобладание монозиготных близнецов по сравнению с дизиготными. Высокая распространенность семейного саркоидоза также была описана в Ирландии [34], но в этой стране саркоидоз имеет широкое распостранение. В этом исследовании, 9.6 % пациентов с саркоидозом имели по крайней мере одного родного брата/сестру с саркоидозом. В сравнительном исследовании в Финляндии и Японии, распространенность семейного саркоидоза была сопоставима, составляя 3.6-4.7 % в Финляндии и 2.9-4.3 % в Японии [35], несмотря на значительное различие в распространенности саркоидоза между этими двумя регионами (28.2 и 3.7 на 100,000, соответственно) [15].
Наиболее информативное исследование в этой области было проведено в Детройте. Авторы оценили 727 случаев саркоидоза из 91 семьи [36]. Распространенность семейного саркоидоза в этом исследовании была 13.5 %. Наиболее интересным результатом было то, что семейный саркоидоз чаще обнаруживался среди чернокожих (18.9 %) чем у белых (5.2 %). Другими словами, чернокожие в четыре раза более вероятно имели члена семьи с саркоидозом. Это говорит, что чернокожие семьи с саркоидозом - вероятно лучшая модель для идентификации генетической предрасположенности к болезни.
Паттерн наследования семейного саркоидоза исследован плохо. Headings [37] оценил частоту наследования в 60-70 % при исследовании 11 афро-американских семей, предполагая полигенное наследование, принимая во внимание, что James [38] предполагал рецессивное наследование. Однако, оба исследования имели множество проблем, включая небольшой размер. Rybicki [39] исследовал 3,395 сибсов (родных братьев/сестер) и родителей 558 пациентов с саркоидозом (361 чернокожих и 197 белых). Были использованы индивидуальные вероятности риска, основанные на возрасте, поле и расе для оценки риска у родителей и родных братьев/сестер пациентов с саркоидозом. Была обнаружена существенная гетерогенность семейного риска болезни. Семьи с высоким риском, более вероятно, были чернокожими (OR =3.24) и имели потомка или родственника второй степени родства с саркоидозом (OR = 6.21). Существенная гетерогенность семейного риска означает, что существуют подгруппы пациентов с различными этиологиями болезни, например с большим генетическим или большим компонентом окружающей среды.
Объясняют ли факторы окружающей среды семейную группировку саркоидоза?
Легко понять, что факторы окружающей среды могут быть ответствены за семейную группировку саркоидоза. Однако, в этом случае, относительные риски предполагаемых агентов окружающей среды должны быть настолько высоки (> 100), что предыдущие исследования должны были бы их обнаружить [6].
Подходы к идентификации генов саркоидоза
Из предыдущих параграфов ясно, что исследование сложных болезней, таких как саркоидоз, который вероятно определяется взаимодействием нескольких генов с несколькими факторами окружающей среды и не имеет простого Менделевского наследования, едва ли может быть выполнено с помощью традиционных стратегий, используемых для простых Менделевских болезней. Анализ сцепления состоит из локализации гена, ответственного за болезнь с помощью поиска свидетельств косегрегации маркера ДНК с фенотипом болезни. Одной из причин трудностей изучения сложных болезней является отсутствие большого числа семей с большим числом индивидуумов с болезнью. Эти соображения особенно важны для саркоидоза, для которого относительный риск (RR) - риск повторения болезни у родственника пациента деленный на риск во всей популяции, довольно низок (0.3-2) [3, 40]. Другие факторы - генетическая гетерогенность болезни, неполная пенетрантность и присутствие модификационного изменения фенотипа (фенокопии).
Несмотря на сложность ситуации, существенный прогресс был достигнут в обнаружении и характеристике генов, вовлеченных в сложные болезни. Используются две различные стратегии: сканирование генома и анализ гена-кандидата.
Сканирование генома
Сканирование генома подразумевает отсутствие специфического гена-кандидата из-за неполного знания биохимических основ болезни. Вышеупомянутый традиционный анализ сцепления, не может быть легко применим к саркоидозу. Привлекательные альтернативы - метод общих аллелей, нацеленный на оценку маркеров, общих в данном локусе среди пар родственников с болезнью [42]. Самый простой из этих методов - анализ родственных пар, в котором частота общих аллелей определяется среди родственников с болезнью по сравнению с ожидаемым случайным наследованием с вероятностью 50 %. Такая стратегия успешно применялась в прошлом при идентификации локуса восприимчивости для существенной артериальной гипертонии и сахарного диабета первого типа [41]. Анализ родственных пар более предпочтителен для анализа сцепления при саркоидозе, по с равнению с традиционным анализом LOD (логарифм отношения шансов), потому что: 1) семьи обычно имеют не более 2-3 членов с саркоидозом; и 2) саркоидоз - состояние, которое часто разрешается спонтанно, и поэтому недиагностированные случаи значительно ослабляют статистическую мощность метода LOD [40].
Анализ генов-кандидатов
Эта стратегия основана на исследовании частот специфических вариантов гена в группе несвязанных индивидуумов с болезнью по сравнению с частотами в групппе контроля, состоящей из несвязанных, здоровых индивидуумов. Эта стратегия подразумевает знание, по крайней мере частичное, биохимической основы болезни и знаний о функции вариантов гена. Важная проблема, связанная с этими исследованиями - огромное число предполагаемых генов-кандидатов, которые должны быть исследованы для любой болезни. Возможно еще более важная проблема, гетерогенность группы пациентов и группы контроля. Возможный обходной путь решения последней проблемы состоит в том, чтобы создать искусственную группу контроля, состоящую из членов семьи пациентов без болезни [40]. Эта стратегия называется AFBAC (affected family-based controls) [43].
Гены главного комплекса тканевой совместимости
Гены человеческого лейкоцитарного антигена (HLA) главного комплекса тканевой совместимости (MHC) были картированы на коротком плече хромосомы 6. Интерес к участию этого локуса в генетической восприимчивости к саркоидозу датируется серединой 1970-х годов. Патофизиология саркоидоза, подразумевающая опознавание, процессинг и презентацию антигена T-клеткам антигенпрезентирующими клетками, лежит в основе исследования HLA, особенно генов класса II [3]. Роль HLA в восприимчивости и модуляции клинических проявлений болезни может быть обоснована следующим образом: 1) молекулярная мимикрия или антигенная кросс-реактивность между инфекционными организмами и молекулами HLA производит начальную толерантность, которая позволяет инфекционному организму стать агрессивным, например из-за антигенной кросс-реактивности, например, когда индивидуумы, несущие HLA-B27 аллели, неспособны вырабатывать антитела к Klebsiella spp; 2) прямое сцепление патогенов или антигенов со специфическими молекулами HLA; 3) ограничение контроля HLA за иммунным ответом; и 4) аберрация экспрессии молекул HLA на участках активности болезни [20].
Гены человеческого лейкоцитарного антигена класса I (A, B, C) и саркоидоз
По данным авторов, первое исследование связи HLA и саркоидоза было выполнено в 1974 г. у 132 пациентов с саркоидозом Kueppers с коллегами в Западной Германии [44]. Это исследование не смогло обнаружить связь между локусом HLA и болезнью. Впоследствии, множество исследований белых пациентов с саркоидозом, принадлежащим к различным этническим группам, обнаружили связь с HLA-B8. B8 был весьма постоянен: RR = 2.18 в Великобритании [45], RR = 2.22 в Северной Америке [46] и RR = 2.8 в Моравии (Чешская Республика) [47]. Последнее исследование также сообщило о RR = 8.5 для B8/B13. В первом исследовании 32 афро-американских пациентов с саркоидозом связь не была обнаружена [48]. О первом HLA типировании семейного саркоидоза было сообщено в 1978 г. [49]. Все вышеупомянутые исследования были выполнены на серологическом уровне, используя стандартный метод микролимфоцитотоксичности (microlymphocytotoxicity).
Гены человеческого лейкоцитарного антигена класса II (DR, DP, DQ) и саркоидоз
Помимо генов HLA класса I, исследовались гены DR, DP и DQ. У белых пациентов, HLA-DR5 был сильно связан с болезнью у 73 Немецких пациентов (OR = 6.56) [50], принимая во внимание, что никакой связи не было найдено с DR у 107 Итальянских пациентов [51]. В последнем исследовании, связь с HLA-B8 была подтверждена (RR=1.91). Исследование Kunikane [52] включало 53 пациентов и исследование Ina [53] 114 пациентов. Оба исследования обнаружили, что частота HLA-DRW52 была выше у пациентов с саркоидозом чем в здоровой группе контроля. Кроме того, исследование Ina [53] показало увеличенную частоту A1 (RR=8.65), B7 (RR=8.52), Bw46 (RR = 4.14), Cw6 (RR=8.52), Cx46 (RR=6.45), DRw8 (RR = 2.47) и DRW9 (RR=1.90). Никакой связи с DQ не было найдено. Датское исследование 41 пациента [54] показало существенную связь с DRW6 (RR=3.2), но никакой связи с DQ или DP.
Впоследствии, были выполнены молекулярные исследования HLA класса II. Такие исследования снижают частоту неправильных результатов, связанных с серологическом типированием [55]. У 32 Японских пациентов с саркоидозом не было найдено полиморфизма длины фрагмента рестрикции (RFLP) гена HLA-DRB, специфического для саркоидоза, но у пациентов, сероположительных для DRW52, частота полиморфизма длины фрагмента рестрикции была выше, чем в группе контроля [56]. В большой группе Японских пациентов, Ishihara [57] выполнил HLA-DRB1, -DRB3, -DQA1 и -DQB1 генотипирование. Существенная связь с саркоидозом была найдена для DR52-ассоциированных DRB1 аллелей [DRB1*11 (RR=5.9), DRB1*12 (RR 2.9), DRB1*14 (RR=2.8)], DRB1*08 (RR=3.5), DRB3*0101 (RR=3.1), DQA1*0501 (RR=4.6), и DQB1*0301 (RR=3.9). Интересно, что это исследование указывет, что глютамат в позиции 71 (Glu71) DRB1*1302 и лейцин в позиции 11 (Leu11) DRB1*0101, связаны с резистентностью к саркоидозу у Японцев (RR=0.1). Раньше, у 122 Скандинавских пациентов с саркоидозом было обнаружено, что DR17 сильно связана с болезнью (p < 0.001) [58]. DQB1*0201/0202 аллель была также связана с саркоидозом (p < 0.01) .
Ген HLA-DPB1 и саркоидоз
К гену HLA класса II DPB1 было привлечено особое внимание после того, как Richeldi с коллегами [59] продемонстрировали, что бериллиоз сильно связан с аллелем DPB1*0201 HLA класса II, принимая во внимание, что аллель DPB1*0401 имел протективное действие. Анализ показал, что восприимчивость к бериллиозу была связана с заменой Lys на Glu в позиции 69 в b-цепи гена HLA-DP (HLA-DPGlu69). Особенно интересно, что ингаляция бериллия производит гранулемы, патологически неразличимые от саркоидных [8]. Бериллиоз даже называли ''формой саркоидоза известной причины''. Такое соответствие побудило исследователей искать возможную связь между HLA-DPB1 и саркоидозом. В раннем исследовании, частоты аллелей DPB1*0201 и DPB1*0401 не различались между Итальянскими пациентами с саркоидозом и группой контроля [60], но это исследование имело малый размер. Подобный отрицательный результат был ранее сообщен Maliarik [61] при исследовании 69 чернокожих пациентов с саркоидозом, в котором частота HLA-DPGLU69 была немного выше, чем в группе контроля. Те же самые авторы, однако, сообщили о слабой связи с Val36 (OR=2.30) и Asp55 (OR=2.03), предполагая, что они могут вносить вклад в восприимчивость к саркоидозу у чернокожих. Напротив, в исследовании 41 английского пациента с саркоидозом, Lympany с коллегами [62] хотя не смогли найти ассоциацию HLA класса II или подтвердить связь с DPB1, сообщили, что пациенты с саркоидозом (26 из 47) имели аллель DPB1*GLU69, что является значительно более высокой частотой чем в группе контроля (p < 0.02). Schurmann с коллегами [63] в исследовании 37 детей из 17 Немецких семей, описали большую чем ожидалось частоту аллеля DPB1*0201. Однако, Lymphany с коллегами [62] не смогли подтвердить этот результат в большем ряде английских пациентов [64].
Другие гены HLA класса II и саркоидоз
Регион HLA класса II также содержит гены, такие как ген низкомолекулярных полипептидов (LMP) и ген транспортера, связанный с процессингом антигена (TAP) [65, 66]. Гены LMP2 и LMP7 кодируют две подгруппы мультикаталитических протеаз, участвующих в ращеплении антигенных пептидов и сцеплении с молекулами класса I. TAP1 и TAP2 участвуют в транспорте эндогенных пептидов. Последний имеет некоторый интерес при саркоидозе, не только с точки зрения неравновесности сцепления (то есть тенденции для генов, расположенных близко к друг другу на той же самой хромосоме, быть унаследованными вместе), но также и с точки зрения возможной роли их полиморфизмов в нарушении аутотолерантности [64].
Несколько пролиморфизмов генов TAP и LMP были исследованы у Японцев [67-69]. После анализа данных, авторы заключили, что гены TAP и LMP не вовлечены в генетическую восприимчивость к саркоидозу. Существенно меньшая частота аллеля TAP2*0201 у DR5, DR6 и DR8 отрицательных пациентов с саркоидозом, объяснялось неравновесностью сцепления с аллелью DR1 [68]. Исследование полиморфизма интрона 6 гена LMP7 показало высокую частоту аллеля LMP7*C, однако, вторичную связь с HLA-DRB1*08 гена DRB1 [70]. Ранее, Foley с коллегами [64], исследовал несколько полиморфизмов генов TAP1 и TAP2 у 117 английских пациентов с саркоидозом. Генотипы TAP2 Ala565/Thr565 и Thr665/Ala665 были значительно реже представлены в группе пациентов, чем в группе контроля (OR=0.41 и 0.54, соответственно). Кроме того, никакой связи не было найдено между вариантами локуса гена TAP и HLADPB1.
Гены главного комплекса тканевой совместимости класса III
Гены, кодирующие компоненты комплемента C2, фактор B и C4, были картированы в регионе главного комплекса тканевой совместимости (MHC) класса III. Фактор B (BF) и C4 характеризуются полиморфизмами. В раннем исследовании 59 Итальянских пациентов с саркоидозом, BF F аллель была сильно связана с болезнью (29 % против 19 % в группе контроля из 363 индивидуумов, p=0.013) [71]. Это результат, однако, не был воспроизведен в большем ряде пациентов той же этнической группы [51].
Ген фактора некроза опухоли (TNF) расположен в том же самом регионе, ~260 КБ, центромерно к HLA B, и включает гены TNF-a и лимфотоксина-a (также называемого TNF-b). TNF-a является важным медиатором привлечения мононуклеарных клеток, формирования гранулемы и иммунопатогенеза прогрессирующего саркоидоза [2, 3]. Были описаны два биаллельных полиморфизма гена TNF-a: LtaNcol, в интроне 1 гена лимфотоксина-a и TNF-308, в регионе промотора гена TNF-a. Аллели LtaNcol*1 и TNF-308*2 были связаны с более высокими уровнями производства TNF. Ни один полиморфизм не был сильно связан с саркоидозом при исследовании 101 немецкого пациента с саркоидозом [72]. Отсутствие связи с полиморфизмом TNF-308 было зарегистрировано в исследовании Итальянских пациентов с саркоидозом [73]. В Японском исследовании 75 пациентов с саркоидозом, был исследован полиморфизм LtaNcol и полиморфизмы трех генов, кодирующих 70,000 D белок температурного шока (HSP70), картированный в регионе MCH, между локусами C2 и TNF. Ни LtaNcol ни HSP70 гены не были связаны с болезнью [74]. Высокая частота LtaNcol*1 аллели объяснялся неравновесностью сцепления с HLA-DR5, DR6 и DR8.
Гены главного комплекса тканевой совместимости и гетерогенность болезни
Известно, что саркоидоз является гетерогенной болезнью, с переменным клиническим курсом, внелегочным вовлечением и переменным исходом [1]. Связь между генами MHC и фенотипическими вариантами саркоидоза - вероятный генетический аспект болезни, в исследовании которого достигнут определенный успех. Концепция, что иммуногенетические факторы, по крайней мере частично, определяют клиническую гетерогенность саркоидоза, была проверена различными исследователями в различных расовых и этнических группах. Некоторые из уместных результатов, полученных в этой области, приведены в таблице 1.

Визуальное представление многомерного взаимодействия между HLA и клиническими характеристиками саркоидоза, предсталено на рис.
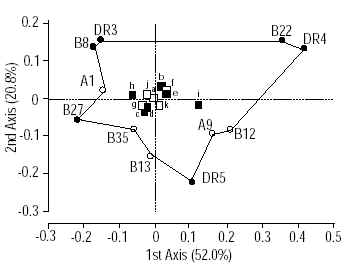
Сравнительные исследования главного комплекса тканевой совместимости в различных расовых и этнических группах
Принимая во внимание расовые и этнические вариации эпидемиологии саркоидоза, обсужденные выше, вероятно наиболее информативным подходом является сравнительные исследования MHC в различных расовых или этнических группах. Во-первых, популяции со смешанным генетическим фоном могут влиять на сцепление. При изучении расово или этнически детерминированных популяций, возможно получили бы объяснения некоторые отрицательные результаты, полученные в смешанных популяциях. Кроме того, появляется шанс обнаружения особенностей HLA, в зависимости от этнических и расовых факторов, что выдвинуло бы на первый план важность генов MHC в восприимчивости к саркоидозу. К сожалению, только несколько исследований использовали этот подход.
В раннем исследовании, типирование HLA класса I было выполнено у 34 белых пациентов с саркоидозом в Британии и у 28 чернокожих из западной Индии африканского происхождения [80]. Английские пациенты характеризовались существенно более высокой частотой Cw7 (RR 34.2) и связью гаплотипа B8/Cw7/ DR3 с хорошим прогнозом. Не имелось ни одной общей особенности с чернокожими из западной Индии. В работе Marinetti с коллегами [20], исследовавших HLA класса I и II в двух этнических группах, у Итальянцев и у Чехов, были получены результаты, различные для этих этнических групп: в Чешской популяции HLA- B13 и -B22 были связаны с мужским полом, ранним началом болезни, внелегочным вовлечением и рецидивами, принимая во внимание, что у Итальянцев, HLA- B13 и -B22 были связаны только с продолжительностью болезни. Наконец, исследование Foley с коллегами [64] полиморфизмов TAP1 и TAP2 гена у 117 Британских и 87 Польских пациентов с саркоидозом, продемонстрировало различную частоту варианта TAP2 Val379 (реже представленного у Польских пациентов; p < 0.02 чем у Британцев) и варианта TAP2 Thr565 (чаще представленного у Польских пациентов; p =0.01).
Гены T-клеточного рецептора
T-клетки являются самым важным фактором в формировании гранулемы при саркоидозе. Эти клетки опознают антигены посредством их клеточных рецепторов (ТКР), которые характеризуются огромным разнообразием из-за перестановки вариабельных, соединительных и дополнительных сегментов a/b или g/d рецептора ТКР [3, 81]. Сегменты кодируются несколькими генами. Несколько исследований показали, что участки саркоидного воспаления характеризуются экспансией олигоклональных популяций T-клеток, таким образом предполагая, что этот иммунный ответ выявляется ''саркоидным'' антигеном [3, 81].
Недавно было сообщено о результатах исследования связи между генами-кандидатами и саркоидозом у чернокожих пациентов [82]. Гены ТКР на хромосомах 7 и 14, IL-1 a, IL-2R b, IRF1 и 4 были вовлечены в T-клеточный иммунный ответ. Авторы не обнаружили свидетельств связи с генамиТКР, но нашли существенную связь для IL-1 и IRF4.
TCR и HLA
У Скандинавских пациентов с саркоидозом была обнаружена корреляция между HLA-DR17 (DRB1*0301) и накоплением в легком CD4+ve T-клеток, экспрессирующих специфическую вариабельную часть TCR гена V 2.3 (также называемую AV2S3) [83]. Свидетельства, что эти клетки имеют идентичные последовательности a-цепи, но различные последовательности нуклеотидов, предполагает возможную селекцию клонов T-клеток для взаимодействия со специфическим саркоидным антигеном (антигенами) [84]. Те же авторы исследовали группу из 16 Японских пациентов с саркоидозом [85]. Известно, что DR3 редок у Японцев, и ни один из пациентов не экспрессировал его. Интересно, что эта особенность была связана с малым числом V2.3+ve CD4+ve T-клеток в легком. Недавно, те же авторы проанализировали связь ТКР/HLA с клиническими особенностями болезни. В группе из 51 DRB1*0301/DRB3* 0101-положительных Скандинавских пациентов с саркоидозом, имелся значительно более высокий процент V2.3+ve CD4+ve T-клеток в легком в подгруппе пациентов с небольшой продолжительностью болезни (< 2 лет) [86].
Эти данные, вместе с ранее сообщенными результатами о связи между HLA-DR3 и благоприятным исходом саркоидоза [20, 58], открывает интригующее предположение относительно природы ''саркоидного'' антигена. Как предложил Grunewald с коллегами [87], так как HLA-DR3 - это высокоспециализированная молекула для презентации микобактериального антигена, нельзя исключать, что микобактерии могут быть вовлечены в патогенез саркоидоза в подгруппе пациентов с благоприятным прогнозом болезни.
Гены иммуноглобулина
Иммуноглобулины (Ig) вероятно играют вспомогательную роль, если таковая вообще имет место, в патогенезе саркоидоза. Однако, уровни иммуноглобулинов при саркоидозе часто увеличены, с увеличенным титром антителом против разнообразных антигенов [88]. Специфические маркеры константной области тяжелой (IGHG) и легкой цепи IgG кодируются группой генов (GM и КМ), расположеных на длинном плече хромосом 14 и 2, соответственно. Несмотря на ограниченную роль Ig в патогенезе саркоидоза, GM и КМ, вместе с генами MCH и ТКР, являются наиболее привлекательными генами, вовлеченными в иммунные болезни. В ранней работе, маркер Ig G3m [5] был обнаружен у 94 из 95 пациентов с саркоидозом [89]. Однако, тот же самый маркер был найден в группе контроля (88 из 97). Ранее, GM и КМ серотипирование было выполнено у 107 Итальянских пациентов с саркоидозом [90]. В этом исследовании GM (3 5 *) фенотип имел защитный эффект (OR = 0.15). Кроме того, GM (3 23 5 *) был реже представлен у пациентов со стадией II и III, по сравнению со стадией I болезни.
Взаимодействие GM/KM и HLA
В том же самом исследовании был исследован эпистаз между GM/KM и HLA [90]. Эпистаз - межгенное взаимодействие, при котором действие одного гена (гипостатического) подавляется действием другого (эпистатического), то есть это отношения типа “доминантность-рецессивность” между неаллельными генами. В этом исследовании, только несколько пациентов, несущих комбинацию GM (3 23 5 *)/Bf S имели стадию II болезни, то есть, эта комбинация имеет ''защитный'' эффект, впервые указывая на взаимодействие между генами GM/KM и HLA класса III. В этом исследовании HLA-DR4, C4BQ0, GM (1,3,17 23 5 *, 21, 28), Bf F были связаны со стадией II болезни, принимая во внимание, что HLA-DR3, 4AQ0, КМ (1), GM (3 23 5 *) были связаны со стадией I.
Ген ангиотензинпревращающего фермента
Ангиотензинпревращающий фермент (АПФ) - металлопептидаза, секретируемая эпителиоидными клетками. Приблизительно у 50-60 % пациентов с саркоидозом серологические уровни АПФ увеличены, так что измерение уровней АПФ, вероятно, является наиболее широко используемым лабораторным тестом при саркоидозе [91]. Увеличенные уровни АПФ также были описаны при других гранулематозных и интерстициальных болезнях легкого, хотя с более низкой частотой. Так как уровни АПФ имеют тенденцию быть выше у пациентов со стадией II и III болезни, было предположено, что уровни АПФ отражают интегральное поражение гранулемами организма.
В Японии [92] и в Италии несколькими годами позже [93], были описаны две семьи, в которых чрезвычайно высокие уровни АПФ наблюдались у нескольких членов семьи (у четырех членов Японской семьи и у пяти членов Итальянской семьи). Три члена Японской семьи и два члена Итальянской семьи были полностью здоровы, и ни один из них не имел патологии кровяного давления. Эти наблюдения вели к концепции возможного генетического контроля уровней АПФ. В 1990 г. было продемонстрировано, что делеция (D) или вставка (I) 250bp фрагмента в интроне 16 гена АПФ объясняет существование трех генотипов АПФ и 47 % фенотипической разницы в уровнях АПФ: DD генотип связан с самыми высокими уровнями, II с самыми низкими и ID с промежуточными уровнями [94].
Так как имеется сильное основание для изучения полиморфизма гена АПФ при саркоидозе, за последние 5 лет было накоплено существенное количество данных для различных расовых и этнических групп. Вероятно этот полиморфизм наиболее хорошо изучен при саркоидозе. Таким образом, имеется удовлетворительная картина участия гена АПФ в саркоидозе во всем мире. 1) Распределение генотипов не различалось между пациентами с саркоидозом и группой контроля в изученных группах белых индивидуумов: Итальянцев [95], Американцев [96] и Финнов [97]; 2) Противоположные результаты были получены у Японцев: никакой связи не было найдено в большой группе пациентов из центральной Японии [98], принимая во внимание, что более раннее исследование обнаружило большую частоту ID или DD генотипов среди женщин (OR 2.18) [99]; 3) DD генотип был существенным фактором риска для чернокожих пациентов (OR 3.17), особенно с историей семейного сароидоза [96]. 4) Никакой корреляции не было найдено между генотипом АПФ и параметрами саркоидоза, такими как рентгенографическая стадия, внелегочное вовлечение и прогресс болезни у Итальянских и Японских пациентов, принимая во внимание, что небольшая корреляция была найдена между генотипом II и прогрессом рентгенографической болезни у чернокожих пациентов [96]. DD генотип связан с худшим прогнозом у Финских пациентов [97]. 5) У Японских пациентов с саркоидозом, кашель и гиперреактивность бронхов сильно связаны с генотипом II [100]. Это объясняется тем, что низкие уровни АПФ инактивируют меньшее количество брадикинина и тахикинина. 6) Наконец, почти все исследования показали, что полиморфизм АПФ объясняет изменчивость серологических уровней АПФ при саркоидозе, таким образом предполагая, что для каждого генотипа должен быть предусмотрен новый диапазон нормы [98]. Итальянское исследование, однако, выдвинуло гипотезу, что рентгенографическая стадия и генотип АПФ действуют независимо от друг друга [95]. В недавнем исследовании Takemoto [101] было показано, что аллель AGTR1 c полиморфизмом в нетранслируемом регионе гена рецептора ангиотензина II тип I, связан с более высокими уровнями АПФ при саркоидозе, таким образом предполагая независимость регулирующего фактора аллеля D в увеличении уровней АПФ при саркоидозе.
Гены хемокинов / медиаторов
Несмотря на огромное количество информации, накопленной за последние 20 лет о роли хемокинов в патогенезе саркоидоза, к этим медиаторам с генетической точки зрения не было привлечено большого внимания. По данным авторов, по этому вопросу имеются только два отчета, оба изданные в 1999 г. Rybicky [83] обнаружил существенную связь IL-1a с маркером на 2q13 и с F13A маркером на 6p23-25. Индивидуумы с IL-1a*137 и F13A*188 аллелями имеют в шесть раз увеличенный риск саркоидоза (OR=6.19). Этот риск был еще выше, если анализ ограничивался пациентами с семейной историей саркоидоза (OR=15.38). Оба гена кодируют медиаторы, уместные для патогенеза саркоидоза: роль IL-1a в индукции гранулемы хорошо известна [2, 3], принимая во внимание, что маркер F13A близко расположен к IRF-4, гену, кодирующему недавно обнаруженного нового члена семейства факторов транскрипции, который действует как важный медиатор формирования саркоидной гранулемы, привлекая T-клетки.
MCP-1 - важный фактор хемотаксиса воспалительных клеток при саркоидозе [102]. C-C рецептор хемокина 2 (CCR2) - рецептор для MCP-1, других хемокинов и вируса ВИЧ. Был описан полиморфизм гена, в котором вариант 64Val -> lle был связан с менее быстрым прогрессом СПИД [103]. Тот же самый полиморфизм был менее частым у 100 Японских пациентов с саркоидозом, чем в группе контроля (OR=0.369) [104]. Это говорит, что вариант CCR2-641 является протектором развития саркоидоза.
Гены синдрома Блау и болезни Крона
Эти гены были недавно картированы на хромосоме 16. Синдром Блау - мультисистемная гранулематозная болезнь, с проявлениями в виде иридоциклита, заднего увеита, повреждений кожи, артрита и камптодактилии. Синдром Блау похож на ювенильный саркоидоз [105, 106]. Кроме того, имеются несколько сообщений о сосуществовании болезни Крона и саркоидоза у различных членов одной семьи [107-109]. Поэтому, регион хромосомы 16, связанный с синдромом Блау и болезнью Крона - хороший регион для поиска генов саркоидоза.
Ген рецептора витамина D
1,25-дигидроксивитамин D3 (1,25(О)2D3) - один из многих продуктов саркоидной гранулемы. Было установлено, что его высокие уровни частично ответственны за увеличенную резорбцию кости [112]. Кроме того, 1,25(О)2D3 модулирует некоторые иммунные реакции. 1,25(О)2D3 связывается с ядрным рецептором витамина D (VDR), кодируемым геном, картированным на хромосоме 12. Биаллельный полиморфизм интрона 8, объясняет существование трех генотипов, bb, bB, и BB, причем bb генотип связан с уменьшенной экспрессией мРНК VDR. Исследование этого полиморфизма у 101 Японского пациента с саркоидозом показало, что, по сравнению с частотами в здоровой группе контроля, наблюдалась более высокая частота bB генотипа (p=0.0196) и B аллели (p=0.0126) [113]. Однако, аллель B не была связана с рентгенографической стадией болезни, ни с внелегочным вовлечением.
Ген белка кистозно-фиброзного трансмембранного регулятора (CFTR) при муковисцидозе
В существующем состоянии знаний о биохимических основах саркоидоза, не имеется никакого очевидного объяснения, связывающего ген CFTR и саркоидоз. Однако, 5 из 8 пациентов с саркоидозом имели по крайней мере одну мутацию гена CFTR [114]. Возможность такой связи впоследствии была подтверждена в большей группе пациентов [115]. По данным обоих исследований, 13 из 34 пациентов с саркоидозом имеют по крайней мере одну мутацию гена CFTR (OR = 5.5).
Эта связь ожидает дальнейшего подтверждения в других группах пациентов. Таже необходим ответ на вопрос, может ли измененный белок CFTR облегчать проникновение инфекционного агента в дыхательные пути и производить иммунный ответ.
Заключение
Свидетельства, накопленные в течение последних двух десятилетий, поддерживают концепцию, что генетические факторы играют важную роль в патогенезе саркоидоза. На основании полученных данных можно утверждать, что общее согласие было достигнуто по двум пунктам : во-первых, гены главного комплекса гистосовместимости (MHC) вовлечены в фенотипические модификации саркоидоза. Во-вторых, предполагается, что генетические факторы являются главными детерминантами расовых вариаций эпидемиологии саркоидоза. Последнее предположение, однако, ограничено малым числом исследований, рассматривающих и генетические и факторы окружающей среды одновременно.
Напротив, поиск генов восприимчивости к саркоидозу все еще находится на ранней стадии. Только несколько генов-кандидатов были интенсивно исследованы. Обнаруженные связи были довольно слабыми. Несколько исследований обнаружили связь с HLA A1, B8, DR3 у белых пациентов, предполагая наличие аутоиммуннного компонента саркоидоза, но эта связь была более слабой, по сравнению с другими болезнями [116]. За эти годы, исследователи создали большие банки ДНК пациентов с саркоидозом, с помошью которых гены-кандидаты могут быть легко и быстро проверены. Однако, чтобы улучшить результаты, желательно разработать общие методы определения фенотипических вариаций болезни. Пример оценки вовлечения органов недавно был сообщен группой ACCESS [117].
В настоящее время проводится исследование двух больших групп пациентов с семейной группировкой саркоидоза, чернокожих в США и белых в Германии. Исследование генома и сравнение результатов даст уникальную возможность проверить существование локуса (или локусов), сильно связанных с саркоидозом и проверять расовые и фенотипические вариации на молекулярном уровне.