J Neurol Sci 2004;227:119-30
Невропатия мелких волокон: важное клиническое состояние
E Hoitsma, JPH Reulen, М. Baets, М. Drent, F Spaans, CG Faber
Резюме
Невропатия мелких волокон (SFN) - невропатия, селективно поражающая миелинизированные и немиелинизированные нервные волокна небольшого диаметра. Интерес к этому состоянию значительно увеличился в последние несколько лет. SFN часто является идиопатической и обычно проявляется периферической болью и/или симптомами вегетативной дисфункции. Диагноз устанавливается на основании клинических особенностей, нормальных результатов исследования проведения нервов и патологических результатов специализированных исследований мелких нервных волокон. Эти исследования включают оценку интраэпидермальной плотности нервных волокон, исследование температурной чувствительности сенсорных волокон и количественный тест рефлексов судоромоторных аксонов (QSART) для вегетативных волокон. Если основная болезнь не идентифицирована, обычно проводится симптоматическая терапия, направленная на облегчение невропатической боли.
Введение
Периферическая невропатия может быть категоризирована на основании функции пораженных нервных волокон, их диаметра или скорости проведения. На основании функции, можно выделить три типа нервных волокон: соматические моторные волокна, соматические сенсорные волокна и вегетативные волокна. Сенсорные функции включают чувствительность к прикосновению, вибрации, температуре и боли. Вегетативные функции включают выделение пота, моторику кишечника, выделение слез, половые функции и изменение кровяного давления и частоты сердечных сокращений. По критерию размера различают миелинизированные нервные волокна большого диаметра (A-альфа и A-бета), миелинизированные нервные волокна среднего диаметра (A-гамма), миелинизированные нервные волокна малого диаметра (A-дельта) и немиелинизированные нервные волокна (C). Волокна A-альфа и A-бета имеют моторные функции и участвуют в чувствительности к вибрации и прикосновению. Волокна A-гамма реализуют моторную функцию нервномышечного веретена. Волокна A-дельта и C участвуют в чувствительности к температуре и боли а также реализуют вегетативные функции. При невропатии мелких волокон (SFN) преимущественно поражаются миелинизированные и немиелинизированные волокна малого диаметра, причем крупные миелинизированные волокна остаются относительно не пораженными.
Рутинные электродиагностические исследования, в которых проверяется функция крупных миелинизированных волокон, у пациетов с SFN не демонстрируют патологии (1-3). Поэтому, синдром SFN часто является загадкой для практических врачей из-за необъяснимого контраста между серьезной болью в конечностях и отсутствием патологии неврологических и электрофизиологических тестов. Новые диагностические методы (исследование температурного порога (TTT), функция сердечно-сосудистой вегетативной нервной системы и интраэпидермальная плотность нервных волокон (IENFD) оцененная при биопсии кожи) облегчают объективное подтверждение клинического диагноза и позволяют охарактеризовать тип поражения нервных волокон при SFN (4,5).
Клинические особенности
Хотя в литературе было опубликовано относительно немного детальных описаний клинических особенностей SFN (1-3,6,7), клинические симптомы являются относительно стереотипными (таблица 3.1). Дисфункция мелких нервных волокон может быть определена как генерализованная периферическая невропатия, при котором миелинизированные и немиелинизированные нервные волокна небольшого диаметра поражаются или исключительно или в намного большей степени, чем миелинизированные волокна большого диаметра (8). Хотя это определение вполне адекватно для концептуального описания SFN, оно не достаточно специфично для применения в клинических исследованиях. Хорошее рабочее определение было предложено Stewart at al (2): ''Особенности, совместимые с SFN включают дисестезию, наряду с ненормальностями неврологической экспертизы, преимущественно ограниченной дисфункцией мелких волокон. Критерии исключения включают потерю проприоцептивных рецепторов в пальцах ног, потерю чувствительности к вибрации на уровне или выше голеностопных суставов, любую дистальную атрофию или слабость, генерализованную арефлексию, патологические результаты электромиографии (ЭМГ) или исследования проведения нервов (NCS)''. Хотя определение Stewart at al (2) весьма специфично и применимо для клинических исследований, это определние является эмпирическим (8).
Таблица 3.1 Симптомы, суггестивные для невропатии мелких волокон
| Сенсорные симптомы | Боль * |
| Парестезии | |
| ''Непереносимость постельного белья'' (sheet intolerance) | |
| Синдром беспокойных ног ** | |
| Симптомы вегетативной дисфункции | Гипо- или гипергидроз |
| Диарея или запор | |
| Недержание или задержка мочи | |
| Гастропарез | |
| Синдром сухости | |
| ''Размытое'' зрение | |
| Приливы крови к лицу | |
| Отсутствие ортостатическое толерантности | |
| Половая дисфункция | |
| Поражение скелетных мышц |
* Боль при SFN часто имеет характер жжения, уколов или прострелов.
** Синдром беспокойных ног - состояние, характеризованное неприятными ощущениями в ногах, которые обычно развиваются до начала сна и являются причиной непреодолимого желания двигаться.
Сенсорные симптомы при SFN обычно состоят из ''положительных'' сенсорных симптомов, включая боль и парестезии (1-9). Боль часто имеет характер жжения, уколов или прострелов. Она может ухудшаться ночью и нарушать сон. Также могут происходить аллодиния и судороги. Судороги часто проиходят в икроножных мышцах и могут вводить в заблуждение клиницистов, если они не знают эту особенность SFN. Некоторые пациенты имеют синдром беспокойных ног (RLS) позднего начала (10). Пациенты с RLS без семейной истории этого состония, должны быть оценены на присутствие SFN. Однако, не все пациенты с SFN страдают от боли. Пациенты могут также иметь ''отрицательные'' сенсорные симптомы, включая нечувствительность, ощушение тяжести и холода. Сенсорные симптомы обычно дистальные (11), но также могут быть очаговыми или асимметричными (7,12,13). Асимметричность симптомов может указывать, что патологический процесс скорее происходит в дорсальном ганглии.
Поскольку вегетативные функции также реализуются мелкимим миелинизированными и немиелинизированными волокнами, также могут развиваться симптомы вегетативной дисфункции (9). Они включают увеличенную или уменьшенную потливость, прилив крови к лицу, изменение цвета кожи, сухой синдром, половую дисфункцию, диарею или запор. Симптомы ортостатической гипотонии развиваются редко, за исключением амилоидоза и диабета (7). Иногда, чрезмерная локальная потливость (например, лицо и грудь), связана с гипогидрозом или ангидрозом, и эта ''чрезмерная'' потливость, о которой сообщает пациент, является нормой на фоне генерализованного отсутствия потоотделения. Степень и распределение вегетативной дисфункции у пациентов с болью в ногах были оценены в проспективном исследовании Novak at al (14). Более серьезные нарушения были отмечены в холинергических и вазомоторных кожных волокнах, с умеренным поражением системных адренергических волокон. Важно помнить, что симптомы вегетативной дисфункции не всегда достаточно серьезны, поэтому пациенты не всегда придают им значение и сообщают о них самостоятельно.
Кроме того, в клинической практике, небольшая вегетативная дисфункция, например крестцовые вазомоторные симптомы или умеренное изменение цвета нижних конечностей не всегда можгу быть полностью оценены. Наконец, поскольку дистальная вегетативная невропатия часто приводит к ортостатической гипотензии а тест Юинга, который широко используется, чтобы оценить вегетативную функцию, часто остается нормальным, вегетативная дисфункция может легко пропущена. Некоторые пациенты отмечают ухудшение симптомов при воздействии высокой температуры, другие - при воздействии холода или при физическй активности. Иногда пациенты сообщали об увеличили чувствительности к атмосферному давлению. Также наблюдаются спонтанные усиления и улучшения SFN. Наконец, многие пациенты с SFN жалуются на серьезную усталость.
Диагностические тесты
NCS и ЭМГ, которые являются ключевыми при оценке невропатии крупных волокон, как правило являются нормальными у пациентов с SFN (15) Недавно предложенные диагностические тесты облегчили подтверждение клинического диагноза SFN. Однако, фундаментальная проблема при оценке результатов диагностических тестов при SFN состоит в том, что золотой стандарт для этого состояния отсутствует. Кроме того, у многих пациентов, функционально различные системы мелких нервных волокон поражаются селективно. Чтобы диагностировать SFN и оценить ее индивидуальный тип, могут быть необходимы дополнительные исследования (16). Наконец, все патологические результаты должны интерпретироваться принимая во внимание клиническую историю пациента, предыдущую терапию и результаты других исследований. Врач устанавливает диагноз на основании клинической истории, физикальной экспертизы, результатов тестов и здравого смысла (17).
Количественные сенсорные тесты
Количественные сенсорные тесты (QST), которые становится все более доступными, стали важным инструментом при оценке функции мелких и крупных сенсорных нервных волокон (18,19). Функция мелких волокон была оценена с помощью измерения температурного порога и порога болевой чувствительности к высокой температуре. Функции крупных волокон были оценены с помощью измерения порога чувствительности к вибрации.
Метод измерения температурного порога (TTT) был рассмотрен Yarnitsky (20). Тепловые стимулы состоят из постепенно возрастающей (тепло) и снижающейся (холод) тепловой энергии, подаваемой через термоэлектрод. По разным данным, чувствительность TTT находится в диапазоне от 60 до 85 % (3,14,21-24). Различия в чувствительности могут происходить из-за технических факторов и различий в подборе пациентов в исследование (7). TTT - психофизиологический метод и поэтому требует сотрудничества пациента. Это означает, что проведение этого теста требует особого внимания, особенно у пожилых пациентов и у симулянтов (18,25,26). Кроме того, важно понимать, что нарушение TTT не является структурной патологией и что нарушение, вызывающее патологический результат ТТТ, в принципе может быть расположенно в любом месте, где-нибудь между кожей и корой головного мозга. Используя два различных типа теста, метод уровней (the method of levels) и метод ограничений (the method of limits), процент ложноположительных результатов может быть уменьшен (27,28). Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology заключила (18), что QST является потенциально полезным инструментом для измерения ухудшения сенсорной чувствительности. Однако, ненормальности, которые демонстрирует QST должны интерпретироваться в контексте общей неврологической экспертизы и других тестов (18).
Тест текущего порога восприятия
Тест текущего порога восприятия (CPT) - количественный сенсорный тест, выполняемый с помошью микропроцессорного электрического нейростимулятора, который формирует синусоидальные электрические импульсы через поверхностные электроды на трех различных частотах: 5, 250 и 2.000 Гц. В настоящее время, единственным устройством для проведения CPT является Neurometer®. Диапазоны изменения тока составляет от 0.01 до 9.99 mA (29,30). Электрический ток непосредственно стимулирует нервные волокна, потому что сила тока прибора является значительно ниже необходимой для стимуляции кожных рецепторов. Пациентов просят идентифицировать присутствие или отсутствие стимула с помощью специального протокола. Из факта, что чувствительность изменяется в зависимости от частоты стимуляции, было сделано заключение, что частота 5 Гц активизирует C волокна, волокна А-дельта стимулируются частотой 250 Гц и крупные А-бета волокна стимулируются частотой 2.000 Гц. Подобно QST, тест CPT требует активного сотрудничества пациента. В клинической практике CPT проводится редко. Кроме того, существуют противоречивые данные относительно полезности этого теста (29).
Биопсия кожи
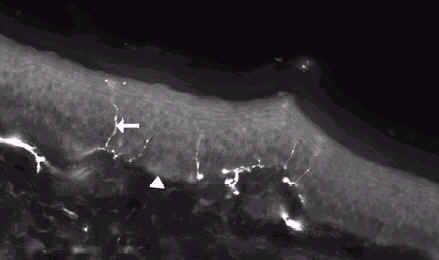
Эпидермальные нервы - дистальные окончания дорсальных нейронов, которые проходят через кожно-эпидермальную базальную мембрану и проникают в эпидермис. Открытие антител к нейропептиду PGP 9.5 (31) сделало возможным эффективно окрашивать большинство нервных волокон (рис. 3.1). PGP 9.5 - убикитин-C-терминальная гидролаза, в больших количествах содержится в эпидермальных нервных волокнах (32-35). Многие исследования подчеркнули важность оценки интраэпидермальной плотности нервных волокон (IENFD) с помощью PGP-9.5 иммунофлуоресцентного окрашивания материала биопсии кожи при оценке SFN (10,21,22,36-55). Перфорационная биопсия выполняется на боковой поверхности лодыжки под местной анастезией 1 % лидокаином (47). Участок проведения биопсии является важным, так как было показано, что IENFD имеет значительно большую диагностическую ценностость на проксимальных, по сравнению с дистальными участками, что видимо связано с природой невропатии (54,56). Поэтому, единственный участок проведения биопсии является достаточным для оценки симметричной сенсорной невропатии мелких волокон (54).

Рис. 3.1 Перфорационная биопсия кожи здорового индивиддума показывает интраэпидермальные нервные волокна (стрелка). Увеличение 200X.
Для проведения количественной оценки числа мелких нервных волокон чаще всего используются два метода. Сначала, был описан метод с использованием анализа изображений с помощью конфокальный микроскопии (47) и подтверждена его валидность (43). Затем, Chien at al (54) исследовали выполнимость диагностирования невропатии сенсорных мелких волокон, используя только световую микроскопию, без использования систем анализа изображений. Результаты обоих методов хорошо коррелировали (r=0.99, p < 0.0001).
Были установлены нормативы IENFD для обоих методов (22,43,47,54-56). В обзоре и мета-анализе Rosenberg at al исследовали диагностическую ценность биопсии кожи у пациентов с SFN. В 9 опубликованных исследованиях (14,21,22,39,40,47,55,57,58), чувствительность и специфичность биопсии кожи составляли 69 % и 97 %, соответственно, у пациентов с симптомами, суггестивными для SFN, но с нормальными результатами NCS. Авторы заключили, что в группе пациентов с SFN положительная биопсия кожи имеет важную диагностическую ценность.
Наконец, наблюдались фокальные эпидермальные утолщения нервных волокон, хотя результаты IENFD были нормальными (40,42,59). Предполагалось, что эти изменения могут быть предегенеративными, однако, точное значение этих повреждений установлено не было.
Проведение биопсии кожи доступно только в нескольких академических центрах, что является серьезным ограничением. Кроме того, до внедрения метода в широкую практику необходимо исследование большой здоровой контрольной группы, поскольку диапазон гистологических особенностей нормальных нервов довольно широк.
Биопсия нерва
Гистологический диагноз невропатии традиционно зависит от ультраструктурной экспертизы ткани нерва, особенно для сенсорных невропатий, поражающих немиелинизированные и мелкие миелинизированные ноцицептивные нервы. Однако, ненормальности могут быть трудно уловимыми и требовать электронной микроскопии и морфометрических исследований. Кроме того, биопсия нерва в конечном счете может вызывать гипоестезию, деафферентную боль и невриному. Поэтому, биопсия сенсорного нерва обычно не показана при оценке пациентов с невропатией мелких волокон, если не подозреваются амилоидоз, васкулит или другой воспалительный процесс.
Лазерные вызыванные потенциалы
Вызванные потенциалы как ответ на сенсорное и болевое возбуждение кожи, могут обеспечивать объективную информацию относительно целостности ноцицептивных афферентов как части периферической нервной системы а также ответа мозга на селективное возбуждение некоторых типов сенсорных волокон. Тепловое возбуждение инфракрасным CO2 лазером производит высокотемпературный импульс, который поглощается поверхностными слоями кожи. Это производит быстрое повышение температуры на поверхности кожи и привоодит к ощущению боли, которое передается мелкими миелинизированными A-дельта и немиелинизированными C-волокнами коре головного мозга. Регистрация с помощью электродов, расположенных на поверхности головы, показывает возникновение вызванных потенциалов с большой и очень большой длительностью, 200-500 мс и 750-1200 мс для A-дельта и C-волокон, соответственно (60,61). Амплитуда потенциалов коррелирует с интенсивностью стимула и сообщенной пациентами интенсивностью восприятия боли. Повторная стимуляция не вызывает привыкания, при этом не имеется никаких свидетельств повреждения кожи (30). Амплитуда вызванных потенциалов имеет большую амплитуду, чем ранние соматосенсорные потенциалы и для исследования в среднем необходимо 25-40 стимулов (62). Хотя это тест имеет важные достоинства, в настоящее время от используется редко.
Высокотемпературная контактная стимуляция
Потенциалы, вызванные высокотемпературными контактными стимуляторами (CHEPs) раньше использовались редко, из-за низкой скорости повышения температуры. Недавно была разработана фольга с чрезвычайно высокой высокой скоростью повышения температуры (70°C/сек), которая может вызывать боль и CHEPs (64-67). Регистрация потенциалов, индуцированных в сенсорно-двигательной области коры головного мозга, выполняется с помощью электродов, расположенных на поверхности головы. При низкой интенсивности стимула, наблюдается небольшая, положительная волна с большим временем задержки на участке Cz. Напротив, три четких пика (Cz/N550, Cz/P750 и Pz/P1000) могут быть идентифицированы при уровнях стимуляции, соответствующих боли. Поздняя компонента Cz/N550 может быть ассоциирована с активацией волокон A-дельта, так как скорость проведения была оценена в 10 м/с. Компонента Pz/N1000 с задержкой 800-1000 мс может быть соответствовать активации C-волокон, со скоростью проведения 2-3 м/с. Таким образом, оценка Cz/N550 и Pz/P1000 может позволить сделать вывод о целостности афферентных периферических A-дельта и C-волокон. Однако, потенциальная ценность этой методики нуждается в дальнейшем исследовании.
Микронейрографическое исследование C-волокон
Микронейрографическое исследование C-волокон является первичным инструментом исследования, однако требует больших затрат времени и высокой мотививации пациента (62,68). При этом исследовании, специальный игольчатый электрод (диаметр 200 мкм) чрескожно вводится в нерв, иннервирующий область пораженной кожи. Электрод связан с усилителем и осциллографом, что позволяет контролировать активность нерва. Регистрация кожной и мышечной симпатической активности, афферентной активности A-бета низкопороговых механорецепторов, ноцицептивных A-дельта и C-рецепторов, позволяет получить патофизиологическую информацию относительно механизмов различных видов нейропатической боли.
Симпатический кожный ответ
Симпатический кожный ответ (SSR) старый, простой, широко доступный и недорогой метод оценки судоромоторной (ответственной за выделение пота) функции мелких волокон. Тест основан на изменении электрического потенциала кожи, вызванным выделением пота, при неожиданном воздействии различных ''адренергических'' стимулов, таких как воздействие электрошока на соматические нервы. Регистрирующие электроды обычно размещают на дорсальной и вентральной поверхности ноги или руки. Имеется общее согласие, что отрицательный результат SSR является патологией (69). Однако неясно, является ли уменьшение электрического потенциала и увеличение времени ожидания ответа надежными индикаторами патологии (70). Главным преимуществом этот теста является то, что он может быть выполнен на обычном электромиографическом оборудовании (71). Однако, чувствительность и специфичность SSR является низкой (7,24,69,72).
QSART
При количественном тесте рефлексов судоромоторных аксонов (QSART), кожные аксоны местно активируются с помощью ионофореза ацетилхолина. Чтобы определить объем выделяемого пота на поверхности кожи, используется судорометр (7,73,74). У пациентов с диабетом QSART является чувствительным, воспроизводимым тестом и его проведение не требует большого времени. Чувствительность QSART при SFN составляет от 59 до 80 % (2,14,22,23,74). Предыдущее исследование показало, что пациенты с SFN могут иметь ненормальности при биопсии кожи и QSART (22). Однако, ненормальности обоих тестов не всегда наблюдаются у пациентов с SFN. Имеется несколько патологических паттернов QSART. Ответ может быть: (1) нормальным, (2) уменьшенным, (3) может отсутствовать, (4) быть чрезмерным или (5) персистирующим. Последний паттерн, состоящий из персистирующей секреции пота, когда стимулирование прекращается, часто отмечен у пациентов с гипералгезией, такой как SFN (8). Точный физиологический механизм этого исследования полностью не известен. Кроме того, для проведения этого теста необходимо специальное оборудование, поэтому он используется редко.
Другие исследования судоромоторной функции
Другие тесты для оценки судоромоторной функции включают тест термогеруляции (TST) и метод с использованием силастика (8). При TST, на кожу пациента наносится специальный порошок (ализарин красный, карбонат натрия и кукурузный крахмал), который становится фиолетовым при намокании. Пациента помещают в горячее влажное помещение и определяется паттерн поверхности тела, где выделяется пот. Результат оценивается полуколичественно. Нормой считается относительно равномерное выделения пота по всему телу, с характерными областями более сильной и слабой потливости (69). Чувствительность это теста вероятно является высокой TST может быть одним из наиболее чувствительных тестов при SFN, который показал низкое выделение пота в ногах пациента (69). Недостаток этого теста заключается в том, что он загрязняет поверхность кожи, является полуколичественным, требует много времени и наличия специального помещения, чтобы обеспечть температуру 44-50 °C и относительную влажность 35-45%.
Метод с использованием силиконовой резины (силастика) был предложен Kennedy (75) как количественное исследование морфометрии. Силастик, который твердеет в течение нескольких минут, наносится на кожу. Ионофорез пилокарпина или ацетилхолина используется для стимулирования потоотделения. Капли пота оставляют отпечаток на силастике и затем определяется количество активных потовых желез на квадратный сантиметр. Чувствительность этого метода не была оценена.
Измерение температуры поверхности кожи
При этом исследовании производится измерение температуры поверхности кожи с помощью бесконтактного инфракрасного термометра на нескольких участках с двух сторон, включая латеральную и медиальную часть бедра, ног и рук. Распределение температуры поверхности кожи на нижних конечностях рассматривается как патологическое, когда различия между участками измерений различаются более чем на 1°C по крайней мере на трех участках (14,77). Преимущество этого метода заключается в простоте, поэтому он широко используется.
Лазерная Допплеровская флоуметрия
Лазерная Допплеровская флоуметрия (LDF) - технология, использующая факт, что эритроциты двигаются по кожным капиллярам. Метод основан на эффекте Доплера и детально описан Shepherd и Oberg (78). Пространственные различия кожного кровотока могут заметно влиять на полученные результаты. Метод часто используется для измерения вазоконстрикции в ответ на различные стимулы, такие как холод (80), аэрозоли (81) и глубокое дыхание (16) и сосудорасширяющих реакций в ответ на тепло (80) и электрофорез ацетилхолина (82). Например, тепло вызывает симпатический сосудорасширяющий ответ. Поэтому, отсутствие усиления кровотока при воздействии тепла может быть связано с нарушением функции симпатических нервов. Однако, важно помнить, что этот ответ ослабляется с возрастом (80).
Проверка кардиоваскулярного рефлекса
Состояние симпатической и парасимпатической нервной системы иногда оценивают с помощью метода Вальсальвы, измеряя изменение кровяного давления в вертикальном положении и при наклоне и измеряя изменение частоты сердечных сокращений при глубоком дыхании и приёме Вальсальвы (тест Юинга) (83). Этот тест широко доступен, но его чувствительность при SFN является низкой (2,14,24).
Сцинтиграфия с метайодбензилгуанидином
123-метайодбензилгуанидин (123I-MIBG), аналог норадреналина, является радиоактивным индикатором функционирования симпатических нейронов. 123I-MIBG вводится внутривенно и накапливаеттся в кардиальных симпатических нервах. Это позволяет визуализировать симпатическую иннервацию сердца с помощью сцинтиграфии (84). Тест Юинга является косвенным методом оценки симпатической и парасимпатической нервной системы и является менее точным и чувствительным чем 123I-MIBG (86). Однако, так как золотого стандарта оценки денервации сердца нет, чувствительность и специфичность сцинтиграфии с 123I-MIBG остается неизвестной. Миокардиальная сцинтиграфия с 123I-MIBG может быть легко выполнена и не требует специального оборудования. Поэтому, этот метод может стать широко доступным.
Патогенез и этиология
В некоторых случаях, SFN является частью основной болезни (таблица 3.2).
Таблица 3.2 Причины невропатии мелких волокон
| Идиопатические (1) | |
| Наследственные | Семейный амилоидоз (107) |
| Аутосомная рецессивная наследственная невропатия (51,142,143) | |
| Наследственная сенсорная и вегетативная невропатия (144) | |
| Болезнь Фабри (49,145,14) | |
| Синдром Росса (37) | |
| Атаксия Фридрейха (22,147) | |
| Танжерская болезнь (7) | |
| Приобретенные | Сахарный диабет (148,149) |
| Нарушение толерантности к глюкозе (57) | |
| Алкоголизм (150,152) | |
| Системный амилоидоз (153-155) | |
| Васкулит (88,156) | |
| Саркоидоз (24,90) | |
| Болезнь Сьёгргена (91) | |
| Системная красная волчанка (92,157) | |
| Синдром Гийена-Барре (158) | |
| Предшествующая вирусная инфекция (89,159) | |
| ВИЧ (48,160,161) | |
| Антисульфатидные антитела (22,162) | |
| Гиперлипидемия (163) | |
| Региональный комплексный болевой синдром (complex regional pain syndrome) (164-166) | |
| Паранеопластический синдром (167,168) | |
| Нейротоксичная терапия (169-171) |
Однако, специфической этиологии для большинства пациентов с SFN, с которыми сталкиваются в неврологической практике, особенно у пожилых пациентов (93 %), идентифицировано не было (22). Нейропатология SFN в значительной степени остается неизвестной. Однако, имеются некоторые предположения об участии ишемии, цитокинов и окислительного стресса в равитии SFN:
Естественное течение и прогноз SFN
Подолжительные исследования естественного течения SFN до настоящего времени не проводились. Из продолжительного наблюдения известно, что по крайней мере у некоторых пациентов SFN прогрессирует до сенсорной невропатии крупных волокон (22,104). Наш опыт указывает, что прогресс SFN является медленным и, хотя иногда развиватся боль и вегетативная дисфункция, пациенты не станоятся инвалидами. Иногда наблюдается спонтанная ремиссия (1). Tobin at al (23) сообщили, что приблизительно треть их пациентов с идиопатической SFN имели постоянные симптомы, другая треть - перемежающиеся симптомы и еще треть пациентов имела монофазный курс SFN с разрешением спектра симптомов через несколько месяцев или лет. Поражение симпатических нервов может играть роль в прогнозе SFN, поскольку индекс вегетативной кардиальной дисфункции был идентифицирован как сильный показатель смертности (105-113). Однако, этот аспект SFN нуждается в дальнейшем исследовании.
Терапия
Если причина SFN, поддающаяся лечению (таблица 3.2) не найдена, терапия обычно сосредоточена на лечении невропатической боли (7,114). Литература по невропатической боли может быть разделена на три группы: диабетические невропатии (наиболее хорошо изученное патологическое состояние), невропатии, ассоциированные с ВИЧ и остальные виды невропатии. Имеется важное различие между ВИЧ-ассоциированными невропатиями, диабетическими и остальными типами невропатиями. Лекарства, которые были эффективны при лечении диабетических и других видов невропатий, были неэффективны при лечении ВИЧ-ассоциированных невропатий. Поскольку не имеется никаких различий в эффективности лечения между диабетическими и остальными невропатиями, мы считаем возможным экстраполировать результаты исследований диабетической невропатии на все невропатии, исключая ВИЧ-ассоциированную невропатию. При невропатии, исключая ВИЧ-ассоциированную, наиболее часто используются противосудорожные средства (115-117), трициклические антидепрессанты (114,117,118), опиаты (116-119) и местный капсаицин в виде крема (120-122) (таблица 3.3).
Таблица 3.3 Терапия, наиболее часто используемая при SFN
| Препарат | Дозировка* | Диапазон дозировки | NNT*** |
| Трициклические антидепрессанты** | |||
| Амитриплитин | 10 мг в день; увеличение на 10 мг в неделю | 75-100 мг в день | 2.6 (2.2-3.3) |
| Нортриптилин | 10 мг в день; увеличение на 10 мг в неделю | 75-100 мг в день | |
| Селективные ингибиторы обратного захвата серотонина** | |||
| Циталопрам | 10 мг в неделю; увеличение на 10 мг в неделю | 20-60 мг в день | 6.7 (3.4-435) |
| Пароксетин | 10 мг в неделю; увеличение на 10 мг в неделю | 20-60 мг в день | |
| Антиконвульсанты** | |||
| Габапентин | 300 мг в день; увеличение на 300 мг в неделю | 1800-3600 мг в день | 3.7 (2.4-8.3) ## |
| Карбамазепин | 200 мг в день; увеличение на 200 мг в неделю | 800-1600 мг в день | 3.3 (2.0-9.4) |
| Окскарбазепин | 300 мг в день; увеличение на 300 мг в неделю | 1200-2400 мг в день | данных нет |
| Ламотригин | 50 мг в день; увеличение на 100 мг два раза в неделю | 200-600 мг в день | данных нет |
| Фенитоин | 100 мг в день; увеличение на 100 мг в неделю | 300-500 мг в день | 2.1 (1.5-3.6) # |
| Опиаты** | |||
| Трамадол | 150 мг в день; увеличение на 50 мг в неделю | 200-400 мг в день | 3.4 (2.3-6.4) |
| Морфий | 15-30 мг каждые 8 часов | 90-360 мг в день | данных нет |
| Местная терапия | |||
| Капсаицин | 0.075% | На больное место 4 раза в день | 5.9 (3.8-13) |
* По данным Mendell и Sahenk (114)
** per os
*** по данным Sindrup и Jensen (116,123).
# Важно иметь в виду, что плацебо-контролируемое исследование фенитоина не показало существенного эффекта (172).
## При дозировке 3600 мг в день. В исследовании с намного более низкой дозировкой (900 мг в день) никакого эффекта найдено не было (173).
Большинство препаратов которые являются эффективными при SFN, уменьшают интенсивность боли только 30-50 % и такая эффективность редко удовлетворяет пациентов (114). У диабетиков, NNT (number needed to treat) в среднем равно 3 (таблица 3.3). Это означает, что при нейропатической боли, только у одного из трех леченных пациентов боль уменьшалась более чем на 50 %.
Наиболее интенсивно были изучены трициклические антидепрессанты, в настоящее время они являются препаратами выбора первой лиинии. При неэффективности или противопоказаниям к трициклическим антидепрессантам, могут быть использованы габапентин, карбамазепин и трамадол (123). Пока неясно, может ли адекватное улучшение боли быть достигнуто при комбинированной терапии, особенно при использовании фармакологических средств, влияющих более чем на один патогенетический путь развития боли (114).
Амитриптилин и капсаицин не эффективны при лечении ВИЧ-ассоциированной невропатии (124-126). Данные относительно эффективности ламотригина при ВИЧ-ассоциированной невропатии противоречивы (127,128). Возможно, ламотригин имеет некоторую эффективность у пациентов с ВИЧ, которые используют нейротоксичную антиретровирусную терапию (ART) (128).
Эффективность внутривенного гаммаглобулина при идиопатической SFN заслуживает дальнейших исследований (1). Первые ингибиторы альдоредуктазы не уменьшали боль при диабетической невропатии (129-131). Новые ингибиторы альдоредуктазы могут быть выгодны при SFN, однако до их широкого использования необходимо провести дальнейшие исследования (132). Интенсивная терапия диабета также может улучшать диабетическую невропатию (133).
Поскольку провоспалительные цитокины, такие как TNF-alpha вносят вклад в развитие нейропатической боли (93-95), можно выдвинуть гипотезу, что анти TNF-alpha терапия, например инфликсимаб, могла быть выгодна при SFN.
Наконец, имелся определенный терапевтический интерес к фактору роста нервов (NGF) (134) и липоевой кислоте (99,100). В нескольких, хотя не всех исследованиях внутривенного введения антиоксидантов, липоевая кислота улучшала невропатические симптомы а также улучшала вариабельность частоты сердечных сокращений у диабетиков (99-102,135). Однако, пероральный прием липоевой кислоты не эффективен (102).
Фактор роста нервов (NGF) проявляет тропность к сенсорным нейронам и стимулирует регенерацию поврежденный нервных волокон (136). Уровни NGF были уменьшены в ткани-мишени при индуцированном диабете у крыс (137). С другой стороны, рекомбинантный человеческий NGF улучшал течение диабетической, индуцированной химиотерапией и ВИЧ-ассоциированной сенсорной невропатии (138-140). Пока не ясно, являются ли выгоды лечения NGF результатом тропизма или болеутоляющего действия. NGF, антагонисты TNF-alpha и антиоксиданты заслуживают дальнейшего исследования.
Нефармакологические методы для контроля боли также могут быть полезны. Некоторые пациенты испытывают облегчение при использовании холодных или горячих компрессов, массажа, подъема или опускания конечностей. В единственном контролируемом исследовании иглоукалывания для лечения периферической боли, связанной ВИЧ, не имелось никаких различия в эффективности, когда когда иглы вводились в традиционные и фиктивные участки (125). Чрескожная электротерапия (TENS) уменьшает боль и дискомфорт при диабетической невропатии (141). Стимуляторы спинного мозга и введение морфия в полость позвоночного канала могут быть полезны в некоторой группе пациентов, но отдаленная выгода этой терапии остается неизвестной (7)
Заключение
SFN - относительно обычное состояние, которое приводит к серьезным и неприятным симптомам, которые трудно контролировать. Стандартные электрофизиологические тесты при SFN остаются нормальными. Поэтому, SFN может легко пропущена. Имеют ли пациенты с SFN опасность развития внезапной жизнеугрожающей аритмии, нуждается в дальнейшем исследовании. Также необходимы дальнейшие исследования патофизиологии и лечения SFN. Поскольку SFN часто развивается при нескоторых иммунных болезнях, таких как саркоидоз, системная красная волчанка, синдром Сьёгрена и васкулит, возможно эти болезни имеют общие патофизиологические черты, приводящие к развитию SFN. В этом отношении, окислительный стресс и провоспалительные цитокины, такие как TNF-alpha могут целью дальнейших исследований.