СОРОСОВСКИЙ ОБРАЗОВАТЕЛЬНЫЙ ЖУРНАЛ №5 1996 Г.
ВОСПАЛЕНИЕ
Г.И. Абелев
Московский Государственный университет им. М.В. Ломоносова
ВВЕДЕНИЕ
Воспаление - реакция организма на чужеродные микроорганизмы и корпускулярные продукты тканевого распада. Воспаление - основной механизм естественного (врожденного) иммунитета, равно как начальный и заключительный этапы иммунитета приобретенного. Оно выполняет повседневную работу по очистке внутренней среды организма от микроорганизмов. При местной инфекции или остром повреждении тканей воспалительная реакция приобретает характерные внешние признаки: покраснение, сопровождающееся местным повышением температуры, набухание (отек) и боль. Как и всякая защитная реакция, воспаление должно сочетать способность распознавать чужеродную для организма частицу с действенным способом ее обезвреживания и удаления из организма.
ФЕМЕНОЛОГИЯ
Рассмотрим классический пример - воспаление, вызванное занозой, прошедшей под кожу и загрязненной бактериями. В течение первых часов поврежденное место краснеет, в нем повышается температура, оно распухает и становится чувствительным к прикосновению: налицо покраснение, нагревание, отек и боль. Затем в первые дни после возникновения этих признаков образуется нарыв, область вокруг занозы нагнаивается, после чего нарыв прорывается и заноза вместе с накопившимся гноем выбрасывается из организма. Что лежит под этими внешними признаками?
Тканевый урорвень
Заноза проникает в ткань, разрушая ее и разрывая мелкие сосуды. Происходят кровоизлияние и свертывание крови в поврежденном районе. Капилляры кровеносной системы в этой зоне расширяются, увеличивая приток крови в район формирующегося воспаления. Внешне это выглядит как покраснение и местное повышение температуры.
Далее сквозь стенки капилляров в данное место просачивается плазма крови, возникает отек, внешне выглядящий как припухлость. В норме стенки кровеносных сосудов, включая капиллярную сеть, непроницаемы для компонентов крови - плазмы и форменных элементов - эритроцитов и лейкоцитов. Повышенная проницаемость для плазмы крови - следствие специфического изменения стенки сосудов, образования ''щелей'' между плотно прилегающими друг к другу клетками эндотелия. Эндотелий - клеточный пласт, образующий стенку кровеносного капилляра. Клетки эндотелия плотно смыкаются друг с другом, создавая непроницаемую для жидкости и непроходимую для клеток крови границу. В этом же районе наблюдается торможение движения эритроцитов и лейкоцитов (клеток белой крови), которые начинают как бы липнуть к стенкам капилляров, перекатываясь по ним и образуя ''пробки'' в непрерывном потоке клеток, проходящих по сосудам. Два типа лейкоцитов, моноциты и нейтрофилы, начинают активно ''протискиваться'' из крови в окружающую ткань между клетками эндотелия в районе формирующегося воспаления. Этот процесс, называемый диапедезом, приводит к выходу в район воспаления моноцитов и нейтрофилов, клеток, предназначенных для фагоцитоза - поглощения и разрушения посторонних частиц, таких, как бактерии и обломки ткани. Моноциты и нейтрофилы активно передвигаются к источнику воспаления, в нашем случае
к загрязненной занозе. Это целенаправленное активное движение к очагу воспаления носит название хемотаксиса. Придя в очаг воспаления, моноциты превращаются в макрофаги - клетки с тканевой локализацией, активно фагоцитирующие, с ''липкой'' поверхностью, подвижные, как бы ощупывающие все, что находится в ближайшем окружении. Нейтрофилы также приходят в очаг воспаления, и их фагоцитирующая активность возрастает.
Фагоцитирующие клетки накапливаются в очаге воспаления, они активно поглощают и разрушают (внутриклеточно) бактерии и обломки клеток и выделяют ферменты, разрушающие межклеточное вещество соединительной ткани. Процессы, ведущие к фагоцитозу и заканчивающиеся им, и составляют суть нагноения. Кожный покров, окружающий очаг воспаления (нарыв), истончается и прорывается: заноза, обломки клеток и накопившиеся фагоциты выбрасываются из организма. Пораженный участок ткани постепенно восстанавливается.
Таким образом, в воспалении участвуют два компонента: сосудистый, определяющий динамику выхода плазмы и клеток в очаг воспаления и собственно клеточный - накопление и функционирование фагоцитирующих клеток. Каков же механизм описанных процессов? Активация трех главных систем, участвующих в воспалении, определяет состав и динамику ''действующих лиц''. Они включают систему образования кининов, систему комплемента и систему активированных фагоцитирующих клеток.
Образование кининов
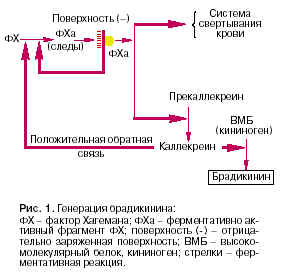
Заноза - кусочек древесины, состоящий из высокополимерных молекул целлюлозы и представляющий собой отрицательно заряженную чужеродную для организма поверхность. На ней адсорбируется так называемый фактор Хагемана (ФХ) - один из начальных компонентов системы свертывания крови. Этот белок, предшественник специфической протеазы, присутствует в крови и имеет сродство к отрицательно заряженным поверхностям. В жидкой фазе крови он спонтанно диссоциирует на два фрагмента - ФХа и ФХб с сильным преобладанием недиссоциированной формы. ФХa адсорбируется на поверхности занозы, где стабилизируется. Он обладает протеолитической активностью (прортеолиз - ферментативное расщепление белка), субстратом которой являются сам ФХ и другой белок - прекаллекреин, также являющийся предшественником протеазы (рис. 1). Прекаллекреин, отщепляя под действием ФХа фрагмент, превращается в протеазу (протеазы - ферменты, расщепляющие белки) каллекреин.
Каллекреин резко усиливает образование ФХа из ФХ и одновременно действует на новый субстрат, так называемый высокомолекулярный белок (ВМБ). Этот белок под действием каллекреина отщепляет короткий пептид брадикинин, который состоит из 9 остатков аминокислот и является одним из главных медиаторов воспаления. Брадикинин действует на эндотелий сосудов, вызывая ''размыкание'' краев клеток сосудистого эндотелия и открывая тем самым путь плазме крови в очаг воспаления.
Таким образом, данная система, во-первых, обнаруживает чужеродное тело и делает это по его отрицательно заряженной поверхности. Поверхности же собственных клеток устроены так, что они не адсорбируют ФХа, не стабилизируют его и не индуцируют тем самым дальнейшую цепь событий. Это самый простой и примитивный способ отличать ''свое'' от ''не своего'', используемый организмом в естественном иммунитете. Вторая особенность системы образования кининов - ряд каскадных усилений начальной реакции. Каскадное усиление определяется ферментативными звеньями реакции, резко усиливающими эффект первичных взаимодействий. В рассмотренной цепи реакций таких каскадных усилений три. Первое - при адсорбции ФХa
на поверхности и образовании положительной обратной связи ФХa ФХ ФХa + ФХб; второе - при образовании каллекреина, энзиматически действующего на ФХ с образованием ФХа, который, в свою очередь, ведет к образованию каллекреина, и третье - при ферментативном действии каллекреина на предшественник брадикинина. Таким образом, ''точечная'' начальная реакция на чужеродной поверхности порождает макроскопические, видимые простым глазом физиологические изменения в формирующемся очаге воспаления.
Активированный ФХ индуцирует и систему свертывания крови, что способствует изоляции очага воспаления (см. рис. 1).
Комплемент
Вторая, более тонкая система врожденного иммунитета - система комплемента (С). Она включает одиннадцать белков крови, в большей части представленных неактивными предшественниками протеаз. Активация системы комплемента в естественном, то есть врожденном, иммунитете начинается с его третьего компонента (СЗ). C3 спонтанно диссоциирует на СЗа и C3b, образуя следовые количества этих фрагментов. C3b ковалентно связывается с поверхностью бактериальной клетки, стабилизируется там и проявляет протеолитическую активность по отношению к белку В, превращая его в фрагмент Bb (рис. 2). К фиксированному на клеточной поверхности C3b специфически присоединяется Bb, образуя ферментативно активный комплекс C3bBb, направленный к исходному С3 и следующему компоненту комплемента С5, который он расщепляет на С5а и C5b. Таким образом, на мембране бактериальной клетки формируется стабильный и ферментативно активный комплекс, обладающий двойной энзиматической активностью - генерацией новых молекул C3b/С3а и C5b/С5а. Компоненты C3b и C5b фиксируются на мембране, они сами по себе обладают биологической активностью. Что касается С3а и С5а, эти полипептиды, состоящие соответственно из 77 и 74 аминокислотных остатков, остаются в среде, являясь сильнейшими медиаторами воспаления (см. рис. 2).
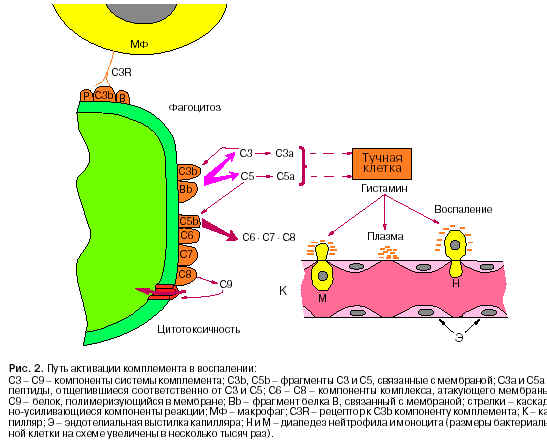
Компонент C5b образует на мембране новые центры ферментативной активности, направленные на активацию особого комплекса, атакующего мембрану. Последний состоит из нескольких компонентов, последовательно активирующих друг друга и фиксирующихся на клеточной мембране, присоединяясь друг к другу (C6ЦC8). Конечный компонент системы комплемента (C9) включается в комплекс, атакующий мембрану, и становится начальным звеном полимеризации. Присоединяя к себе несколько таких же, как и он сам, молекул, он погружается в мембрану, полимеризуется в кольцо и образует поры, ''продырявливающие'' оболочку клетки, что ведет к ее гибели. Таким образом, система комплемента распознает чужеродную клетку и запускает цепную реакцию активации биологически активных белков, что ведет к приобретению комплексом токсической активности и гибели клетки.
Кроме того, компонент C3b (и в меньшей степени C5b), фиксированный на поверхности бактериальных тел, резко усиливает их фагоцитоз. Это обусловлено присутствием на мембране фагоцитирующих клеток рецепторов к C3b и C5b, которые существенно повышают сродство фагоцитов к бактериям, покрытым C3b и C5b. Это чрезвычайно важный феномен, один из главных в антибактериальном иммунитете.
Иная судьба у растворимых факторов С3а и главным образом С5а. Эти биологически активные пептиды обладают рядом свойств, важных для развития воспаления: прямым действием на проницаемость сосудов и, самое главное, способностью активировать так называемые тучные клетки (см. рис. 2).
Тучные клетки активно синтезируют и хранят большие запасы мощного медиатора воспаления, биологически активного амина - гистамина. Тучные клетки рассеяны повсеместно в соединительной ткани и особенно вдоль кровеносных сосудов. Они несут на своей поверхности рецепторы к С3а и С5а, и, когда к ним присоединяются эти пептиды, тучные клетки секретируют гистамин в окружающую среду. Роль гистамина в воспалении многогранна. Во-первых, он быстро и резко влияет на сосудистую капиллярную сеть. Эндотелий капилляров под его воздействием выделяет сосудорасширяющие вещества, и проток крови через очаг воспаления существенно возрастает (покраснение и нагрев). Между клетками эндотелия образуются ''щели'', и плазма выходит из капилляров в зону воспаления, свертываясь и изолируя тем самым распространение инфекции из очага. По градиенту концентрации гистамина фагоциты ''поднимаются'' к источнику воспаления. Таким образом, гистамин действует подобно брадикинину, но более активно и быстро, благодаря чему и является медиатором острой фазы воспаления.
Возвращаясь к комплементу, следует еще раз подчеркнуть многонаправленность его действия (токсичность для микроорганизмов, усиление фагоцитоза, генерация медиаторов воспаления) и каскадное усиление всех направлений его активности.
И опять в случае комплемента возникает вопрос, как его начальный компонент C3b отличает ''чужую'' поверхность от ''своей''. И другой вопрос: как ограничивается каскадно разрастающийся процесс и почему он не захватывает весь организм? C3b может фиксироваться на биологических мембранах ''своих'' или бактериальных клеток, но мембраны собственных клеток обладают защитными системами - белками, которые препятствуют образованию комплекса C3bBb и делают C3b чувствительным к протеазе сыворотки крови, разрушающей его. Эта же протеаза разрушает C3b, находящийся в несвязанной форме, и тем самым препятствует распространению ''каскада'' по организму. Такова система комплемента. Очевидно, что она стоит в центре формирования воспаления и прямо ведет к его важнейшему компоненту - фагоцитозу.
Фагоцитоз
Фагоцитоз был открыт и понят как важнейший элемент воспаления и естественного иммунитета И.И. Мечниковым в 1882 году. Громадная роль фагоцитоза не только во врожденном, но и в приобретенном иммунитете становится все более очевидной благодаря работам последнего десятилетия. Как уже говорилось, фагоцитоз начинается с диапедеза фагоцитов и накопления их в очаге воспаления. Главную роль в этом процессе играют моноциты и нейтрофилы. Моноциты, придя в очаг воспаления, превращаются в макрофаги, тканевые фагоцитирующие клетки. Фагоциты, взаимодействуя с бактериями, активируются, их мембрана становится ''липкой'', в цитоплазме накапливаются гранулы, наполненные мощными протеазами. Возрастают
поглощение кислорода и генерация активных форм кислорода (кислородный взрыв), включая перекись водорода и гипохлорит, а также окись азота (рис. 3).
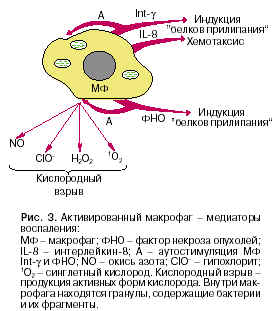
В дополнение к перечисленным признакам активации макрофаги начинают выделять в среду мощные медиаторы воспаления, среди которых особой активностью отличаются так называемый фактор некроза опухолей (ФНО), g-интерферон (Int-g) и интерлейкин-8 (IL-8). Все они являются биологически активными пептидами, дополняющими действие брадикинина и производных системы комплемента - С3а и С5а.
Какова же их роль в воспалении? Начнем с ФНО. Это небольшой белок, синтезируемый и секретируемый макрофагами, обладает множественной активностью. Он активирует сами же макрофаги и нейтрофилы, а также индуцирует синтез и экспрессию на мембране клеток сосудистого эндотелия особых белков, специфически взаимодействующих с углеводами клеточной поверхности моноцитов и нейтрофилов. Поверхность эндотелия благодаря этому становится ''липкой'' для этих клеток.
IL-8 играет в воспалении особую роль - он вызывает появление в клетках эндотелия рецепторов, реагирующих с моноцитами и нейтрофилами с высоким сродством, так что эти клетки останавливаются в капиллярах, расположенных в районе воспаления. IL-8 наиболее эффективен в создании градиента для хемотаксиса фагоцитирующих клеток. Именно IL-8 наряду с другими факторами воспаления стимулирует моноциты и нейтрофилы к диапедезу и миграции по его градиенту в очаг воспаления. Фагоциты имеют рецепторы к IL-8, которые ''чувствуют'' разницу в его концентрации со стороны, обращенной к его источнику, и с противоположной стороны и направляют свое движение по оси максимального отличия.
Int-g также ''многоцелевой'' медиатор воспаления. Одна из главных его функций - аутоактивация макрофагов и активация нейтрофилов. Как уже упоминалось, в этих клетках резко усиливается синтез протеаз, которые накапливаются в специальных цитоплазматических органеллах - лизосомах. В них происходит ''кислородный взрыв'' - продукция активных форм кислорода и окиси азота, высокотоксичных для микроорганизмов. Поверхность фагоцитов становится ''липкой'', так как количество различных рецепторов на ней, включая рецепторы к C3b, резко увеличивается, как увеличивается и ''ощупывающая'' подвижность цитоплазмы этих клеток. Когда такая клетка встречается с бактерией, то она ''прилипает'' к поверхности фагоцита, обволакивается его псевдоподиями (выросты цитоплазмы, непрерывно образующиеся и исчезающие, как бы ощупывающие микроокружение клетки) и оказывается внутри клетки, где и разрушается протеазами. Так заканчивается цикл ''воспаление - фагоцитоз''. Мы видим, насколько мощный и многогранный защитный механизм действует в этом случае.
Однако его слабость в его однообразии, как бы в монотонности механизма, срабатывающего одинаково при встрече с различными врагами. Естественно, что многообразные, живые и многочисленные популяции микроорганизмов вырабатывают обходные пути для проникновения в организм.
Одни микробы начинают синтезировать белки, функционально сходные с теми, которые не дают C3b фиксироваться на собственных клетках организма, другие ''одеваются'' в капсулу, резистентную к токсическому действию комплемента. Иные микробы синтезируют специфические протеазы, ''срезающие'' хеморецепторы моноцитов и нейтрофилов, и клетки теряют направление движения в очаг воспаления. Наконец, имеются и такие микроорганизмы (например, микобактерии, вызывающие туберкулез или проказу), которые после захвата их макрофагом поселяются в нем, и макрофаг становится безопасным ''домом'' для их развития и существования. В таких ситуациях естественный иммунитет бессилен, и в дело вступают уже более изощренные и гибкие механизмы иммунитета приобретенного.
Литература
1. Абелев Г.И. Основы иммунитета // Соросовский Образовательный журнал. 1996. № 5. С. 4 Ц 10.
2. Пол У. Иммунология: В. 3т. М.: Мир, 1987. Т. 1. Гл. 24 и 27.
3. Ройт А.Основы иммунологии. М.: Мир, 1991.
4. Ульянкина Т.И. Зарождение иммунологии. М.: Наука, 1995.
5. Хэм А., Кормак Д. Гистология: В 5 т. М.: Мир, 1983. Гл. II.
Гарри Израилевич Абелев, доктор биологических наук, профессор, член-корреспондент РАН, академик РАЕН, руководитель лаборатории иммунохимии НИИ канцерогенеза ОНЦ РАМН им. Н.Н. Блохина. Автор более 220 научных работ, одной монографии.


