I. ВВЕДЕНИЕ
A. Гормоны и цитокины: определения
Определить, что понимать под терминами ''гормон'' и ''цитокин'', не является легкой задачей. Действительно, исследования, рассмотренные в этой статье, изменили много традиционных мнений относительно того, каково должно быть определение этих классов молекул. Однако, сначала мы должны объяснить читателям, что мы подразумеваем под терминами ''гормон'' и ''цитокин'', когда используем их в этом обзоре.
Классическое определение гормона из учебника эндокринологии гласит : '' гормон - это биомолекула, которая производится специализированным типом клеток, секретируется эндокринной железой непосредственно в кровоток и действует на отдаленные целевые клетки или ткани, регулируя клеточную активность, существовавшую до этого времени на этом участке''. Химически, гормоны могут быть маленькими или большими полипептидами, белками, гликопротеидами, производными ароматических аминокислот или стероидами. Например, полипептид кортикотропин (АКТГ), секретируется кортикотрофами (специализированными клетками) передней доли гипофиза (эндокринная железа) в кровоток и действует преобладающе на кору надпочечников (целевой орган) и увеличивает секрецию глюкокортикоидов. С одной стороны, возможно, это слишком узкое определение гормона, потому что много ''классических'' гормонов также синтезируются и действуют в пределах мозга или производятся и действуют на периферии. С другой стороны, это возможно слишком широкое определение, потому что согласно этому определению CO2, произведенный мышцами при физической нагрузке и стимулирующий дыхание, также можно рассматривать как гормон. Однако, это довольно точное описание, поскольку именно так большинство людей думет о гормоне, действующем ''классическим'' эндокринным образом.
В отличие от гормонов, которые обычно связывают с эндокринной системой, цитокины всегда были связаны с иммунной системой. Определение цитокина дать еще труднее, чем определение гормона. Мы посчитали, что определение, используемое в ''The Cytokine Handbook'' (862) будет наиболее полезным при написании этого обзора. Здесь цитокины определены как ''регулирующие белки, секретируемые лейкоцитами и другими клетками; плейотропные действия цитокинов включают многочисленные действия на клетки иммунной системы и модуляцию воспалительного ответа''. Это определение является несколько узким в том смысле, что слишком подчеркивает важность иммунной системы как источника и цели цитокинов, но вероятно наиболее точно отражает то, как большинство людей думает о цитокинах. Конечно, это лучшее определение, которое применялось в то время, когда большинство работ, описанных в этой статье были выполнены. Термин ''цитокин'' также охватывает термины ''монокины'' (моноцитарные/макрофагальные медиаторы) и ''лимфокины'' (лимфоцитарные медиаторы), которые обычно использовались в более ранних исследованиях, описанных в этом обзоре.
В таблице 1 собраны все известные особенности гормонов и цитокинов. Хотя это может быть спорным, можно считать, что если большинство характеристик молекулы в таблице 1 находится в колонке цитокинов, то это молекула - цитокин, если большинство характеристик находится в колонке гормонов, то это гормон. Необходимо помнить, что одно и то же химическое вещество может классифицироваться по-разному в зависимости от условий рассмотрения. Например, пролактин, произведенный гипофизом и действующий на молочную железу, явно действует как ''эндокринный гормон''. Однако, пролактин также может действовать на лимфоциты; в этой ситуации его можно классифицировать как цитокин. Возможно самое важное различие между цитокинами и гормонами, заключается в том, что цитокины преобладающе регулируют местные процессы, принимая во внимание, что гормоны преобладающе функционируют как системные регуляторы.
Таблица 1. Особенности цитокинов и классических эндокринных гормонов
| Цитокины | Классические эндокринные гормоны | |
| Структура | Большие полипептиды, белки или гликопротеиды. | Маленькие или большие полипептиды, белки, гликопротеиды, производные ароматических аминокислот или стероиды. |
| Клеточный источник | Секретируются лейкоцитами и многими другими клетками в различных тканях и органах. | Секретируются одним типом специализированных клеток в пределах эндокринной железы. |
| Концентрация у здоровых индивидуумов, не подвергнутых стрессу | Очень низкая (фактически нулевая). Заметно увеличивается в течение болезни, при повреждении или восстановлении ткани. | Обычно поддается измерению, может иметь пульсирующий или циркадный паттерн секреции. |
| Участок секреции и действия | Действуют преобладающе местно, паракринным или аутокринным способом. | Действуют на удаленные целевые клетки. |
| Активность | ''Плейотропный'' эффект, различные целевые клетки, широкий спектр действия. | Диапазон действий высоко переменный: многие гормоны передней доли гипофиза (например, ТТГ, АКТГ), имеют ограниченное действие, но ''целевые'' гормоны (например, T3, T4 и глюкокортикоиды) имеют очень широкий диапазон действий. |
| Избыточность | Имеют широкий спектр перекрывающихся биологических действий (то есть, ''избыточность''). | Имеют гораздо меньше перекрывающихся биологических действий; дефицит единственного гормона обычно производит существенные ненормальности. |
| Функция | Преобладающе действуют как регуляторы местных процессов. | Действуют преобладающе как системные регуляторы гомеостаза. |
B. Концепция двунаправленной связи между иммунной и нейроэндокринной системой: историческая перспектива
О регулировании иммунной системы надпочечниками было известно уже в середине 19 века, когда Томас Аддисон (3) обнаружил, что пациент с недостаточностью надпочечников имел увеличенное число циркулирующих лимфоцитов. В соответсвии с этим наблюдением, удаление надпочечников у крысы производило гипертрофию тимуса (орган, ответственный за производство зрелых лимфоцитов) (363). Возможно лучшие из известных экспериментальных исследований, проведенные Гансом Селье (764, 765), показали, что увеличение надпочечников и инволюция тимуса были общими особенностями ответа животного на стресс, независимо от природы стресса. Эти ранние исследования предположили близкую связь между физиологией надпочечников и иммунной системой.
Изоляция активной субстанции, производимой корой надпочечников, кортизона, была произведена Kendall и Reichstein в конце 1940-х. Способность кортизона подавлять воспаление (335), поддерживала гипотезу, что секреция глюкокортикоидов (GC) надпочечниками играет существенную роль в регулировании иммунологических процессов. Однако, даже при том, что существенное увеличение плазменной концентрации GC наблюдается в ответ на все типы стрессовых стимулов, большинство исследователей считало, что иммуносупрессия, производимая GC, имеет скорее фармакологическое, чем физиологическое значение. Эти результаты привели к широкому использованию GC для лечения аутоиммуннных и воспалительных болезней. Только в конце 1970-х, работы Besedovsky, del Rey, Sorkin позволили установить, что физиологическая роль GC заключается в предотвращении чрезмерной активности иммунных реакций при сохранении их специфичности (67, 191). В обзоре, сделанном в начале 1980-х, Munck с коллегами (567) укрепили эту концепцию. Эти авторы предположили, что эндогенное действие GC заключается в предотвращении чрезмерного усиления иммунного ответа, таким образом ограничивая ответ хозяина при борьбе с агрессорами (например, патогенами), что не позволяет гиперактивной иммунной системе наносить вред хозяину (например, аутоиммунные болезни). Более современное исследование показало, что влияние GC на иммунологические процессы является более сложным, чем генерализованное подавление активности иммунной системы и зависит от типа иммунной активности и субпопуляции иммунных клеток, участвующих в иммунной реакции (531). Однако, ясно, что эндогенные GC являются ключевым регулятором функции иммунной системы.
Затем, Besedovsky (73) предположил, что кроме того, что GC имеет глубокое действие на иммунную активность, обратное также является верным - иммунная активность влияет на секрецию GC. Эта гипотеза выросла из экспериментальных наблюдений, что при развитии иммунного ответа на инородные антигены (эритроциты овцы), у крыс развивается параллельный эндокринный ответ, характеризованный увеличенными плазменными уровнями кортикостерона (73). Кроме того, введенние мышам супернатанта периферической крови, стимулированых конканавалином A или клеток селезенки, производит один или большее количество факторов (GC-increasing factors - GIF), которые увеличивают концентрацию кортикостерона в крови (68). Эти результаты предполагали существование иммунно-нейроэндокринного регулирующего механизма обратной связи, посредством которого иммунные клетки ограничивали собственную активность, секретируя молекулы, которые стимулируют секрецию GC надпочечниками.
Концепция ''двунаправленной связи'' между иммунной и эндокринной системами была признана после основополагающих работ Blalock с коллегами в начале 1980-х. Они разработали молекулярное основание для такой двунаправленной связи (80-82, 952, 953). Их ранние исследования показали общность действия иммунорегуляторов (например, интерферонов) и гормонов (например, норадреналина) (84). Эта группа обнаружила, что множество классических гормонов не только секретируется классическими эндокринными железами (например, гипофиз) но также производится клетками иммунной системы (например, лимфоцитами). Например, они показали, что лимфоциты синтезируют АКТГ, гормон, который является главным физиологическим регулятором секреции GC надпочечниками (792). Кроме того, они продемонстрировали, что лимфоциты производят АКТГ, эндорфин, тиротропин и соматотропин (792, 794, 951) и что эти гормоны были способны влиять на иммунологические процессы (79, 83, 370, 371). Последующие исследования продемонстрировали, что множество гормонов (например, пролактин, инсулино-подобный фактор роста) также производится лимфоцитами (372, 556, 557, 621).
Обнаружение, что лимфоциты способны синтезировать молекулу, подобную АКТГ, вместе с демонстрацией, что у гипофизэктомизированных мышей наблюдалось проризводство кортикостерона в ответ на вирус болезни Ньюкасл (NDV), вело Blalock с коллегами (793) к разработке концепции лимфоидно-надпочечной оси. Согласно этой гипотезе, АКТГ произведенный стимулированными вирусом лимфоцитами действует на надпочечники и увеличиват секрецию кортикостерона. Однако, последующие исследования не смогли воспроизвести индуцированное NDV производство кортикостерона у гипофизэктомизированных мышей (64, 218, 221, 604), что не подтверждало гипотезу. Кроме того, Besedovsky (71) показал, что стимулированные лимфоциты секретируют GIF, которые увеличивают плазменные уровни АКТГ и кортикостерона у крыс и что этот ответ устраняется гипофизэктомией. Учитывая, что электрическая и нейрохимическая активность гипоталамуса также изменяется в течение иммунного ответа (69, 72), Besedovsky (71) предположил, что влияние GIF на секрецию GC надпочечников происходит скорее путем действия на гипоталамный компонент гипоталамо-гипофизо-надпочечной (HPA) оси, чем непосредственно на гипофиз или надпочечники.
Роль GIF стала очевидной с признанием, что классические эндокринные гормоны - не единственный класс медиаторов, вовлеченных в иммунно-эндокринную связь. Действительно, в середине 1980-х стало очевидно, что иммунорегуляторные цитокины также формируют ключевую связь между иммунной и нейроэндокринной системами (70, 331, 532, 966). Blalock с коллегами (966) показали, что IL-1 и IL-6 стимулируют секрецию АКТГ опухолевой линией клеток AtT20 (1). Годом позже, Besedovsky с коллегами (70) продемонстрировали, что системная терапия моноцитарным или рекомбинантным IL-1 увеличивает плазменные уровни АКТГ и GC у нормальных мышей. Кроме того, Besedovsky с коллегами (70) продемонстрировали, что нейтрализация эндогенного IL-1 ингибирует GC ответ на экспериментальную вирусную инфекцию (NDV) у крыс. Последний эксперимент ясно показал, что наблюдение стимулирующих эффектов цитокинов на нейроэндокринную секрецию не были просто фармакологическими явлениями и указал, что IL-1 играет важную эндогенную роль в регулировании HPA оси в течение вирусной болезни. Действительно, исследования Besedovsky и Blalock показали, что цитокины могут быть экстрагипоталамными кортикотропин-ризизинг-факторами (CRF), производимыми поврежденной тканью, о чем ранее сообщалось Broddish с коллегами в 1970-х (112, 113, 497).
В 1987 г. журнал Science опубликовал работы трех независимых лабораторий (55, 62, 730). Одно из этих исследований (62) продемонстрировало прямое действие IL-1 на секрецию АКТГ культурами клеток передней доли гипофиза крысы, таким образом поддерживая более ранние исследования Blalock с коллегами (966) которые предположили прямое действие IL-1 на гипофиз при секреции АКТГ. Наоборот, два других исслеледования (55, 730) обнаружили, что IL-1 не стимулирует секрецию АКТГ культурами клеток передней доли гипофиза, несмотря на факт, что IL-1 in vivo увеличивает плазменную концентрацию АКТГ и GC. Они показали, что индуцированная IL-1 секреция АКТГ in vivo зависит от секреции и действия гипоталамного пептида CRF, который - является главным фактором, усиливающим секрецию АКТГ. Эти результаты ясно указывают на гипоталамус, как на участок, на котором происходит ответ HPA оси на IL-1 и поддерживает идею, что иммунорегуляторы могут влиять на активность центральной нервной системы (ЦНС).
Противоречие относительно вероятного первичного участка действия IL-1 (ЦНС, гипофиз или надпочечники) в стимулировании гипофиз-надпочечной секреции, продолжились много лет и подробно рассматриваются в секциях IV и V. Однако, в настоящее время накоплено большое количество данных, которые указывают, что IL-1 и другие цитокины могут быть сигналами для мозга. Параллельно с исследованиями связи между иммунной системой и HPA осью, большое количество работ указало, что лихорадка, вызванная патогенами, происходит в результате производства иммунными клетками ''эндогенного пирогена'' способного передавать сигналы ЦНС (23, 420). Этот эндогенный пироген позднее был идентифицирован как IL-1 (420). Кроме того, экзогенный IL-1 производит много изменений в ЦНС, включая изменения в поведении (уменьшение репродуктивной активности, изменение поведения, мотивированного пищей и увеличение сна), изменения уровня метаболизма и активности множества нейроэндокринных осей (54, 65, 408, 409, 439, 440, 529, 683, 708).
Эти исследования показали наличие регулирования IL-1 ответа ЦНС на периферические изменения активности иммунной системы. Кроме того, общий медиатор влияния на различные ответы ЦНС, дает молекулярное обоснование для наблюдаемого стереотипного ответа на иммунные вызовы разнообразного происхождения. Эта фаза ''острого ответа'' характеризуется лихорадкой, подавлением аппетита, анорексией, изменением концентрации катионов в плазме, синтезом специфических белков печени (белки острой фазы) и изменением нейроэндокринной секреции (441). В настоящее время установлено, что фаза ''острого ответа'' производится путем сложных взаимодействий между IL-1 и другими цитокинами.
Начиная с исследований Besedovsky и Blalock, стало очевидно, что IL-1 имеет мощное действие на секрецию большинства гормонов (см. таблицу 2). Кроме того, более современные исследования показали, что изменения нейроэндокринной секреции производятся не только IL-1, но и многими другими цитокинами. HPA ось стала наиболее интенсивно изучаемой нейроэндокринной системой в отношении влияния цитокинов и способности увеличивать секреторную активность этой оси интерлейкинами, фактором некроза опухоли, хемокинами, гемопоэтином, интерферонами, факторами роста и нейротрофинами.
Таблица 2. Влияние IL-1 на нейроэндокринную секрецию
| Нейроэндокринная система | Эфффект | Ссылки |
| Гипоталамо-гипофизо-надпочечная ось | Увеличение секреции | 863, 883, 959 |
| Гипоталамо-гипофизо-гонадная ось | Уменьшение секреции | 683, 715, 882, 886 |
| Гипоталамо-гипофизо-тиреоидная ось | Уменьшение секреции | 336, 358, 665, 886 |
| Секреция соматотропина | Уменьшение или увеличение секреции | 634, 922 |
| Секреция пролактина | Уменьшение или увеличение секреции | 671, 689 |
| Секреция гормонов гипофиза | Увеличение секреции | 158, 159, 446, 992 |
| Секреция катехоламинов | Увеличение секреции | 54, 695 |
Эта статья рассматривает результаты исследований, которые демонстрируют 1) какие цитокины влияют на секрецию гормонов HPA осью, 2) что под влиянием некоторых физиологических / патофизиологических обстоятельств, эндогенные цитокины регулируют активность HPA оси, 3) на каком уровне (гипоталамус, гипофиз или надпочечники) действуют цитокины, и 4) какие анатомические и фармакологические факторы участвуют в действии цитокинов на гипоталамус. Чтобы достичь этой цели, мы разделили эту статью на секции, соответствующие этим целям. Мы начинаем с краткого представления биологии цитокинов (см. секцию. IC) и функциональной анатомии HPA оси (см. секцию ID).
C. Цитокины
1. Цитокины и семейства рецепторов цитокинов
Цитокины - большие (8-60 kDa), растворимые полипептиды, которые регулируют рост, дифференцирование и функцию различных типов клеток (см. таблицу 3). Большинство цитокинов классически было связано с регулированием иммунных и/или воспалительных процессов. В пределах иммунной системы, их действия проявляются паракринным или аутокринным способом. Однако, из-за того, что иммунная, нейроэндокринная и центральная нервная система имеют общий химический язык, признано, что цитокины имеют намного более разнообразные действия. Соответственно, экспрессия этих полипептидов и их рецепторов не ограничена клетками иммунной системы, а также обнаружена во многих других тканях (включая мозг и эндокринные железы). Кроме иммунорегуляции, многие цитокины имеют мощное действие на разнообразные физиологические процессы. Например, многие цитокины стимулируют лихорадку, сон, анорексию, недомогание и изменения нейроэндокринной секреции. Наконец, способность некоторых цитокинов регулировать гомеостатические процессы в тканях, отдаленных от участка их производства, позволили твердо установить роль цитокинов как ключевых регуляторов скоординированных местных и системных ответов на травму и инфекцию.
Таблица 3. Семейства цитокинов
| Семейство | Члены семейства | Основные действия |
| Интерлейкины | IL-1 - IL-18 | Классификация в качестве интерлейкина не подразумевает функцию. Интерлейкины имеют многочисленные и разнообразные иммунорегуляторные действия; некоторые интерлейкины имеют выраженные провоспалительные действия (например, IL-1, IL-1, IL-8, IL-9), принимая во внимание, что другие имеют противовоспалительные эффекты (например, IL-1ra, IL-4, IL-10, IL-13). Многие интерлейкины также стимулируют системные аспекты острой фазы (например, лихорадку). |
| Фактор некроза опухоли | TNF-alpha, TNF-beta | Цитотоксичность по отношению к опухоли; обширные иммунологические действия; индукция многих других цитокинов; иммуностимуляция; медиатор воспалительного ответа. |
| Интерфероны | IFN-alpha, IFN-beta, IFN-gamma | Ингибируют репликацию вирусов; производят регулирование специфического иммунного ответа. |
| Хемокины | IL-8/cinc/gro/NAP-1, MIP-1alpha, -beta, RANTES | Хемотаксис, активация клеток на участках воспаления. |
| Гемопоэтины (нейропоэтины) | IL-6, CNTF, LIF, OM, IL-11, CT-1 | Все нейропоэтины используют рецептор gp130 для передачи сигналов; разнообразные действия на B-клетки и другие иммунорегуляторные действия; продлевают жизнь нейронов. |
| Колониестимулирующие факторы | G-CSF, M-CSF, GM-CSF, SCF, IL-3, IL-5 | Способствуют росту и дифференцированию клеток-предшественников в костном мозге; увеличивают число или активность клеткок различных линий (гранулоцитов, макрофагов и эозинофилов). |
| Нейротрофины | NGF, BDNF, GDNF, NT-3, NT-6 | Рост и дифференцирование нейронов |
| Факторы роста | IGF-I, IGF-II, EGF, aFGF, bFGF, PDGF, TGF-alpha, TGF-beta, activin | Рост и дифференцирование клеток |
Классификация цитокинов на семейства является несколько произвольной. За исключением нескольких гомологичных пептидов (например, IL-1alpha и -beta; IFN-1alpha и -beta; и TNF-alpha и -beta) большинство цитокинов имеет мало подобия. Следовательно, классификация цитокинов основана на функциональных признаках, целевых рецепторах или клетках происхождения. Наиболее обычно, цитокины классифицировались в семейства фактора некроза опухоли (TNF), интерлейкинов, интерферонов (IFN), хемокинов, гемопоэтинов (или нейропоэтинов) и колониестимулирующих факторов (CSF). Из-за подобия действия, особенно в пределах ЦНС и периферической нервной системы, факторы роста (GF) и нейротрофины (NT), нередко подпадали в семейство цитокинов. Их действия перекрываются с множеством цитокинов, принадлежащих к более чем к одному семейству (см. таблицу 3). Например, IL-6 не только интерлейкин, но также и член семейства гемопоэтических или нейропоэтических факторов, которые используют идентичный рецептор (gp130) для передачи сигналов (416). Кроме того, IL-1, IL-3, IL-5 и IL-6 - также являются CSF.
Одна из поразительных особенностей цитокинов - способность проявить множество различных действий (способность, известная как ''плейотропность'') и наоборот, много различных цитокинов производят одни и те же биологические действия (способность, известная как ''избыточность'') (162, 633). Плейотропность цитокинов возможно связана с широкой распространенностью рецепторов цитокинов на многочисленных типах клеток и способности механизмов трансдукции, активизированных цитокинами, изменять экспрессию разнообразных целевых генов. Функциональная избыточность различных цитокинов, по крайней мере частично, была объяснена при идентификации и молекулярном клонировании многих рецепторов цитокинов. Некоторые, хотя конечно не все, рецепторы цитокинов состоят из комплекса, включающего компонент, связывающий цитокин-специфический лиганд и класс-специфического компонента трансдукции сигнала (416, 733). Кроме gp130, подобные рецепторы также были обнаружены для IL-2, IL-4 и IL-7 (733) а также для IL-3, IL-5 и гранулоцито-макрофагного CSF, которые имеют общий рецептор KH7 (552). Однако, избыточность цитокинов нельзя полностью объяснить наличием общих рецепторов, поскольку, например, IL-1, IL-6 и TNF-alpha, имеют много общих биологических действий, несмотря на использование различных поверхностных рецепторов (см. таблицу 4).
Таблица 4. Общие биологические действия IL-1, IL-6 и TNF-alpha
| Иммунологические свойства | Активация T-клеток и B-клеток. Неспецифическая резистентность к инфекции. |
| Нейроэндокринные действия | Активация гипоталамо-гипофизо-надпочечной оси. Подавление гипоталамо-гипофизо-гонадной оси. Подавление гипоталамо-гипофизо-тиреоидной оси. |
| Влиняие на ЦНС | Анорексия. Гиперметаболизм. Лихорадка. |
| Влияние на печень | Синтез белков острой фазы |
Хотя имееются данные, что цитокины могут играть роль в некоторых ''нормальных'' физиологических процессах, например при сне (605, 606, 838, 839), физической нагрузке (138, 139, 815, 920) и овуляции (2, 137), экспрессия большинства цитокинов в здоровых тканях очень низка. Однако, производство цитокинов заметно увеличивается в течение ''тканевого стресса'', который производится разнообразными клеточными факторами, включая периоды быстрого клеточного роста, ремоделирования ткани, болезни, инфекции или травмы. Специфические цитокины, произведенные в ответ на угрозу тканевому гомеостазу зависят от характера угрозы (например, бактериальная, вирусная, воспалительная), типу клеток или ткани, которых касается угроза, гормональной среды и в большой степени от профиля других цитокинов, которые производятся на этом участке.
Еще одна поразительная особенность - множественные взаимодействия между различным цитокинами. Многие типы взаимодействий очевидны, включая стимулирующее или подавляющее действие на уровне синтеза цитокинов. Например, провоспалительные цитокины TNF-alpha и IL-1 стимулируют производство множества других цитокинов, включая друг друга, а также IL-6, IL-8, IL-9, воспалительного белка макрофагов (MIP) и CSF (206). Напротив, противовоспалительные цитокины IL-4, IL-10 и IL-13 аннулируют производство многих провоспалительных цитокинов (например, IL-1, IL-8, IL-12, TNF-alpha, IFN-gamma и CSF) (122, 563), принимая во внимание, что IL-6 ингибирует производство IL-1 и TNF-alpha, но стимулирует производство эндогенных рецепторов IL-1, антагонистов IL-1ra (379, 743). Кроме того, имеются многочисленные примеры специфических цитокинов, влияющих на клеточный ответ на другой цитокин. Например, почти все биологические ответы или на TNF-alpha или IL-1 могут быть усилены, когда эти два цитокина действуют вместе (206), принимая во внимание, что активин функционально противодействует действиям gp130 цитокинов (114).
Большая склонность к взаимодействиям цитокин-цитокин иллюстрируется большим количеством различных цитокинов, которые могут быть произведены при единственной угрозе клеточному / тканевому гомеостазу. Например, наличие в крови эндотоксинов, вызывает увеличение синтеза IL-1alpha, IL-1beta, IL-1ra, IL-6, IL-8, IL-10, IL-12, TNF-alpha, MIP, MIF, IFN-gamma, фaктора ингибирования лейкоцитов (LIF) и гранулоцито-макрофагального CSF. Поэтому очевидно, что при угрозе тканевому гомеостазу, физиологический результат определяется результирующим взаимодействием между множеством цитокинов.
Хотя было показано, что многие цитокины способны влиять на секреторную активность HPA оси, большинство исследований сосредоточилось на цитокинах IL-1, IL-6 и TNF-alpha. Эти три цитокина имеют много общих биологических действий (см.таблицу 4). Секция IC2 дает краткую схему их структуры, биосинтеза и рецепторов.
2. IL-1, IL-6 и TNF-alpha
Имеются по крайней мере три различных гликопротеида, которые составляют семейство IL-1. Два агониста, IL-1alpha и IL-1beta, имеют гомологию последовательностей ~25 %, кодируются различными генами и демонстрировали аналогичную активность в многочисленных иследованиях (205). Оба цитокина синтезируются как молекулы-предшественники с массой 31-kDa. Про-IL-1beta биологически инактивный и требует протеолитического дробления IL-1beta-превращающим ферментом (ICE, также известный как каспаза -1) (401). Кроме того, был описан эндогенный антагонист рецепторов IL-1 (IL-1ra), который имеет существенную гомологию с IL-1alpha и IL-1beta, связывает рецепторы IL-1, но имеет недостаточную биологическую активность (225, 318). IL-1ra использовался как фармакологический инструмент, чтобы исследовать роль взаимодействий рецепторов IL-1-IL-1 при физиологических ответах (203). Интересно, что эндогенный IL-1ra секретируется теми же типами клеток и в ответ на те же стимулы, как и IL-1 и эндогенный IL-1ra играет важную роль в регулировании физиологических ответов на эндогенный IL-1 (260, 485). Недавно, был предложен четвертый член семейства IL-1. IL-18 (также известный как фактор, индуцирующий IFN-gamma, IGIF) демонстрировал 12 и 19 % структурную гомологию с IL-1alpha и IL-1beta, соответственно (46). Вследствие этого, IL-18, первоначально был назван IL-1gamma (46). Хотя пока имеется очень мало информации относительно этого нового цитокина (850), известно, что стимулированное липополисахаридом (LPS) производство зрелого IL-18 требует ICE (249, 287, 307). Кроме того, IL-18 и сам IL-1 имеют общие синальные молекулы (428) и функциональные действия (351), что также указывает на близкую связь между этим новым цитокином и семейством IL-1.
У млекопитающих, были описаны два различных мембранно-связанных рецептора IL-1 (IL-1R1 и IL-1R2) (784). Оба рецептора являются гликопротеидами и принадлежат к семейству иммуноглобулинов и обладают единственным трансмембранным доменом. Каждый рецептор связывается IL-1alpha и IL-1beta и IL-1ra, но с различной аффинностью (784). Было предположено, что биологические действия IL-1 производятся исключительно посредством IL-1R1 (442, 785), а IL-1R2 функционирует исключительно как ''ложная цель'', которая ограничивает биодоступность IL-1 для взаимодействия с IL-1R1 (163, 784, 786). Напротив, некоторые исследования продемонстрировали, что моноклональные антитела против IL-1R2 (ALVA 42), ингибируют некоторые действия IL-1 в пределах мозга (493, 548), хотя способность этих антител связывать IL-1R2 не наблюдалась (282). Кроме двух изоформ рецепторов, было обнаружено, что белок IL-1RAcP увеличивает сцепление IL-1 с IL-1R1 (304, 482) и играет критическую роль в передаче клеточных сигналов через этот рецептор (348, 433, 994). Несколько дополнительных членов семейства рецепторов IL-1 были идентифицированы на основании гомологии последовательности (53, 94, 278, 488, 489, 550, 627, 989). Один из этих белков, IL-1Rrp, недавно был идентифицирован как функциональный рецептор для IGIF/IL-18/IL-1gamma (869).
Фактор некроза опухоли также имеет две формы, TNF-alpha и TNF-beta, которые имеют гомологию ~50 %. TNF-beta (лимфотоксин альфа) преобладающе производится активизированными лимфоцитами. Напротив, TNF-alpha экспрессирован у разнообразных клеток как 26-kDa мембранная молекула. Клетки также могут производить 17-kDa растворимую форму, которая является медиатором клеточного иммунного ответа. Фактор некроза опухоли - один из 10 известных членов семейства лигандов, которые активизируют семейство структурно связанных рецепторов. Они включают рецепторы TNF-alpha и TNF-beta, Fas лиганд, фактор роста нерва (NGF) и CD40 лиганд (47). Все лиганды для этих рецепторов состоят из трех цепей полипептидов и большинство являются трансмембранными белками, которые действуют главным образом через взаимодействие клетка-клетка.
Действие TNF-alpha происходит через взаимодействия с двумя различными рецепторами: 55-kDa (TNF-R1) и 75-kDa (TNF-R2) (47). Эти два рецептора являются трансмембранными белками с единственным трансмембранным регионом и экспрессированы на большинстве типов клеток. Хотя внеклеточные области этих двух рецепторов имеют подобную архитектуру, их внутриклеточные области не имеют существенного соответствия, предполагая, что они используют различные пути передачи сигналов (467). Действительно, исследования рецептор-специфических антител (233, 241, 283, 851, 968) и TNF-R-дефицитных мышей (234, 642, 707) показали, что эти два рецептора производят эффекты, которые в значительной степени не перекрываются. Недавние молекулярные исследования пролили свет на действие этих двух рецепторов (182). Закрепление TNF на любом рецепторе активизирует провоспалительный фактор транскрипции NFkappaB. В случае TNF-R2, трансдукция сигнала происходит через гетеродимеризацию рецептора с двумя TNF-R2-связанными факторами, TRAF1 и TRAF2. TRAF2 является медиатором индуцированной TNF-R2 активации NFkappaB. Напротив, TNF-R1, после сцепления с лигандом, привлекает белок TRADD. Подобно TRAF2, TRADD вызывает активацию NFkappaB, но, в отличие от TRAF2, также вызывает апоптоз посредством ICE-подобной протеазы. Это объясняет, почему TNF-R1, но не TNF-R2, вызывает апоптоз. Однако, NH2-терминальный домен TRADD взаимодействует непосредственно с TRAF2 и экспрессия TRAF2 блокирует не только TNF-R2, но также и индуцированную TNF-R1 активацию NFkappaB. Таким образом два рецептора TNF имеют различные пути передачи клеточных сигналов и могут взаимодействовать друг с другом, таким образом объясняя различия и перекрытие сигналов, произведенных двумя рецепторами TNF.
IL-6 - 21-28-kDa гликопротеид, произведенный как лимфоидными, так и нелимфоидными клетками и регулирует иммунный ответ, белковый синтез острой фазы и гемопоэз. Предшественник человеческого IL-6 синтезируется как полипептид, состоящий из 212 аминокислот, который трансформируется с помощью дробления NH2-терминальной последовательности в зрелую форму, содержащую 184 аминокислоты.
В настоящее временя идентифицирован один рецептор IL-6 (IL-6Rlapha). IL-6 принадлежит к семейству цитокинов, которые включают цилиарный нейротропный фактор (CNTF), онкостатин М (OM), LIF, IL-11 и кардиотропин-1 (CT-1), которые имеют общий сигнальный механизм, белок gp130 (415, 416). Комплексы лиганд-рецептор, которые имеют общий сигнальный механизм gp130, формируют гомодимер gp130 или гетеродимер gp130-LIFR. В случае IL-6, передача сигналов начинается при гомодимеризации gp130, индуцированной взаимодействием с комплексом IL-6/IL-6Rlapha. Гомодимеризация gp130 или гетеродимеризация gp130 с LIFR активизирует JAK киназу, и также сопровождается тирозин-специфическим фосфорилированием и ядерной транслокацией члена семейства STAT (STAT3) семейства факторов транскрипции. Кроме того, имеется другой путь передачи сигналов, в котором происходит активация каскада RAS-MAP киназа в сопровождении активации факторов транскрипции, например ядерного фактора IL-6 (NF-IL-6). Это ясный пример того, как различные цитокины имеют подобное биологическое действие (то есть, избыточность).
Рецепторы IL-1, IL-6 и TNF-alpha могут находиться не только в мембранно-связанной форме, но также существуют как ''укороченные'' растворимые рецепторы, которые способны к сцеплению с их лигандом (257, 332, 703). Способность растворимых рецепторов IL-1 и TNF связывать их лиганды ограничивает способность IL-1 или TNF-alpha к взаимодействию с их мембранно-связанными рецепторами и поэтому производит антагонистические свойства этих ''укороченных'' рецепторов. Напротив, растворимый рецептор IL-6 после сцепления с его лигандом, может взаимодействовать с gp130 и проявлять клеточный ответ. Действительно, инкубация IL-6 с его растворимым рецептором демонстрировала, что ранее нечувствительные к IL-6 клетки обретают такую чувствительность и эффективность IL-6 in vivo увеличивается (506, 641, 747). Таким образом биологическая активность цитокина определяется не только его собственной концентрацией и концентрацией цитокинов, которые влияют на его активность, но также и присутствием его растворимых рецепторов.
D. Гипоталамо-гипофизо-надпочечная ось
1. Организация HPA оси
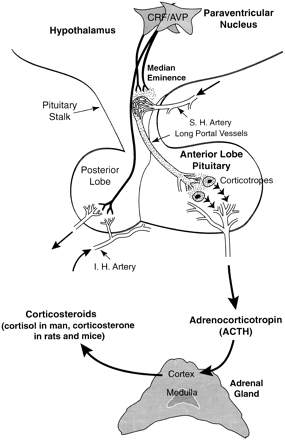
За последние 10-15 лет было опубликовано более 1,000 статей относительно активации HPA оси цитокинами. Это вероятно связано с большим количеством обнаруженных цитокинов, сложностью организации HPA оси (см. рис. 1) и функциональной важности активации HPA оси в течение стресса. Секреция GC необходима для нормального функционирования большинства тканей, и даже небольшие отклонения от нормальных циркулирующих уровней этих стероидов производят изменения разнообразных физиологических и биохимических параметров. Взаимодействия между эндокринной системой и ЦНС проявляются ритмом секреции GC с пиком во время пробуждения и низшей точкой секреции в течение первых часов сна. Уровни GC в крови увеличиваются в ответ на фактически любой стимул, который угрожает или воспринимается как угроза гомеостазу. Глюкокортикоиды действуют на различные цели, усиливая или ингибируя клеточную активность, действия, которые нацелены на обеспечение измененных метаболических, эндокринных, нервных, сердечно-сосудистых и иммунологических потребностей, которые обеспечивают выживание хозяина. Поэтому не удивительно, что регулирование уровней GC в крови подчиняется разнообразным сенсорным регуляторам и эта информация объединяется на уровне гипоталамуса.

Рис. 1. Функциональная анатомия гипоталамо-гипофизо-надпочечной оси. AVP - аргинин вазопрессин; CRF - кортикотропин-рилизинг-фактор.
Основное ядро ЦНС, участвующее в регулировании гипофиз-надпочечной оси - паравентикулярное ядро (PVN) гипоталамуса. PVN - основной источник кортикотропин-рилизинг-фактора (CRF), который является главным физиологическим регулятором секреции АКТГ гипофизом (691). Гипофизотропные нейроны PVN проецируются на внешнюю зону срединного возвышения (МЕ) и секретируют CRF в специализированную капиллярную сеть. Гипоталамус имеет богатую сеть кровеносных сосудов, которые в области срединного возвышения образуют портальную систему. Наиболее васкуляризированы супраоптическое и паравентрикулярное ядро. Гистологически, область срединного возвышения представляет зону контактов, содержащую окончания многочисленных нейронов, локализованных в ядрах гипоталамуса, по которым продукты секреции этих нейронов (гипофизотропные гормоны) достигают капилляров портальной системы гипофиза. Венозные капилляры портальной системы имеют специальные отверстия, создающие возможность перехода соединений с достаточной молекулярной массой из крови в периваскулярные пространства срединного возвышения.
В пределах аденогипофиза, CRF взаимодействует со специфическим рецептором (CRF-R1) на поверхности кортикотропных клеток, что приводит к стимуляции синтеза предшественника АКТГ, проопиомеланокортина (POMC) и секреции АКТГ и других POMC пептидов (888, 898). Адренокортикотропин является мощным стимулятором секреции GC пучковой зоной коры надпочечников. У людей, главный GC - кортизол, но у крыс и мышей, пучковая зона в основном производит кортикостерон. Классическим эндокринным способом (обратная связь), эти стероиды ингибируют синтез и секрецию CRF в пределах гипоталамуса и POMC пептидов в гипофизе (404, 995).
PVN включает две главных нейросекреторных области, магноцеллюлярную (mPVN) и парвоцеллюлярную (pPVN), а также каудальные группы клеток (738). mPVN вместе с преоптическим ядром (SON) составляют магноцеллюлярные нейроны, которые являются главным источником аргинина вазопрессина (AVP) и окситоцина, котрые поступают в кровообращение от нейронов задней доли гипофиза. pPVN - главный источник гипофизотропных CRF нейронов, которые секретируют CRF в портальную систему гипофиза. Гипофизотропные нейроны также производят множество дополнительных пептидов, особенно AVP (740, 864), который в синергизме с CRF стимулирует секрецию АКТГ (693) и синтез AVP этими нейронами может быть увеличен при усилении гипофиз-надпочечной активности (738). Кроме того, AVP и окситоцин, из источников, иных чем pPVN, также могут вносить вклад в увеличение пула веществ, усиливающих секрецию АКТГ (15, 648, 651). Поэтому, хотя принято, что CRF, произведенный pPVN является главным стимулятором секреции АКТГ, в этот эффект также вносит вклад секреция AVP (и возможно окситоцина) pPVN или магноцеллюлярными нейронами, в степени, которая изменяется с характером физиологической угрозы.
С чрезвычайным разнообразием стрессовых стимулов, которые вызывают активацию HPA оси, совместимо предположение, что pPVN получает разнообразные сигналы из областей мозга, передающих висцеральную, соматосенсорную, слуховую, ноцицептивную и визуальную информацию а также информацию из лимбических областей, участвующих в интеграции познавательных и эмоциональных событий (738). Эти сигналы возможно поступают от других ядер гипоталамуса (например, среднее преоптическое ядро передней доли гипоталамуса). Экстрагипоталамные участки получения сигналов возможно включают области как в пределах (например, ядро одиночного пути (NTS) и другие катехоламинергические группы клеток) и вне (сосудистая сеть терминальной пластинки (OVLT) и субфорникальный орган (SFO) гематоэнцефалического барьера (738). Поэтому активность HPA оси может модулироваться на разных уровнях и фактически все регулирующие процессы, описанные выше, были предложены как участки, на которых цитокины регулируют активность HPA оси.
2. Экспериментальная оценка секреторной активности HPA оси
Экспериментальные методы, которые использовались, чтобы исследовать секреторную активность HPA оси в ответ на цитокины, чрезвычайно разнообразны и будут рассматриваться лишь кратко. Очевидный результат увеличения секреторной активности HPA оси - увеличение концентрации АКТГ и GC в крови. Измерение уровня иммунореактивности этих гормонов широко использовалось как средство изучения влияния цитокинов на HPA ось и является основным методом, который использовался в исследованиях человека. Кроме того, в исследованиях на животных эффектов различных хирургических, фармакологических или генетических манипуляций на плазменный гормональный ответ на данный цитокин, дали ценные данные, которые позволили объяснить анатомические и нейрохимические механизмы, участвующие в активации HPA оси специфическим цитокином.
Чтобы оценить активность нейронных компонентов HPA оси в ответ на специфический цитокин, использовалось множество методов, включая использование электрофизиологических регистраторов и гистохимическое определение экспрессии немедленно-ранних генов (cIEG), например c-fos. То, что c-fos является маркером нейронной активности (558), позволило картировать активацию нейронов в ответ на разнообразные стимулы, включая цитокины. В частности стресс-индуцированная индукция мРНК c-fos и-или белка Fos в пределах PVN была полностью исследована и утверждена как валидный способ идентификации активации нейросекреторных нейронов (152, 436). Другой cIEG, NGFI-B, также использовался для подобных целей (152, 436). Идентификация фенотипов клеток в пределах PVN, у которых наблюдается экспрессия cIEG позволяет идентифицировать активацию специфических нейросекреторных нейронов. Однако, должно быть отмечено, что в настоящее время мы не знаем, как индукция этих факторов транскрипции связана с трнскрипционной активностью в пределах PVN. Действительно, из трех пептидов CRF, AVP и окситоцин, только ген AVP включает элемент AP-1, который связывает Fos-Jun димеры, но все три гена содержат элементы, связывающие NGFI-B (152).
Также была проведена количественная оценка нейросекреторной активности PVN нейронов, измеряя 1) концентрацию пептидов непосредственно в портальной крови, 2) концентрацию пептидов в перфузате или при микродиализе в пределах МЕ, и 3) содержание пептида в МЕ у нормальных животных или при добавлении колхицина, чтобы блокировать аксонный транспорт. Наконец, экспрессия мРНК или первичных транскриптов РНК (hnRNA) CRF или AVP в пределах PVN также были изучены.