III. ФИЗИОЛОГИЧЕСКИЕ / ПАТОФИЗИОЛОГИЧЕСКИЕ ОБСТОЯТЕЛЬСТВА, ПРИ КОТОРЫХ ЭНДОГЕННЫЕ ЦИТОКИНЫ РЕГУЛИРУЮТ ГИПОТАЛАМО-ГИПОФИЗО-НАДПОЧЕЧНУЮ ОСЬ
Имеется множество примеров повреждений, инфекций, и/или болезней, которые связаны с увеличением производства цитокинов и сопутствующим увеличением активности HPA оси: травма головы (427, 611, 976), церебральная ишемия (инсульт) (253, 367, 571), множество аутоиммуннных болезней (175, 239, 322-325, 347, 455, 539, 654, 959), психические болезни и деменция (165, 302, 510, 896), синдром приобретенного иммунодефицита (СПИД) (636, 661, 763, 827, 954) и действие антигенов (69, 72, 73). Однако, прямые свидетельствя участия специфических цитокинов в активации HPA оси на эти воздействия ограничены лишь несколькими случаями (вирусная или бактериальная инфекция, местное повреждение ткани и воспаление, острый физический / психологический стресс). Кроме того, хотя было показано, что различные цитокины влияют на секреторную активность HPA оси, прямая демонстрация участия цитокинов в физиологическом или патофизиологическом ответе HPA оси в значительной степени ограничена цитокинами IL-1, IL-6 и TNF-alpha. В следующих секциях выделены различные типы угрозы гомеостазу, которые производят активацию HPA оси посредством механизмов, которые зависят от эндогенного производства цитокинов.
A. Вирусная болезнь
1. Вирус болезни Ньюкасл (NDV)
Первое прямое свидетельство участия IL-1 в ответе HPA оси, было получено в исследовании нейроэндокринного ответа на вакцинацию NDV (70). Вирус болезни Ньюкасл - нейротропный парамиксовирус, который при введении грызунам, производит симптомы вирусной болезни без потенциальной опасности репликации. В пределах 1-2 часов после введения, NDV производит существенное увеличение уровня АКТГ и кортикостерона в крови мышей (70, 219-221, 604, 793) или крыс (685). Большинство исследований продемонстрировало, что увеличение уровня кортикостерона устраняется гипофизэктомией (218, 220, 221, 604), указывая на важность гипофиза в надпочечном ответе. Кроме того, АКТГ ответ полностью устранялся, когда крысы были иммунизированы против CRF (685), указывая, что гипоталамный CRF регулирует АКТГ ответ гипофиза на NDV. Возбуждение HPA оси NDV, возможно, производилось не непосредственно вирусом, а медиаторами, произведенными иммунными клетками в ответ на вирусную инфекцию. Это подтверждается фактом, что супернатант культуры NDV с лейкоцитами периферической крови человека (HPBL) или клетками селезенки мыши, также увеличивает плазменные концентрации кортикостерона. Действительно, интраперитонеальное введение супернатанта NDV плюс HPBL, производит четырехкратное увеличение плазменной концентрации кортикостерона у крыс (70). Этот ответ устраняется инкубацией супернатанта NDV плюс HPBL с антителами к IL-1 (70). Более современные исследования показали, что интраперитонеальное введение IL-1ra мышам через 2 часа после NDV, фактически устраняет увеличение плазменных уровней АКТГ и кортикостерона (221), подтверждая важную роль IL-1 в генерации ответа HPA ответа вирусную инфекцию.
2. Полиинозиновая полицитидиловая кислота
Полиинозиновая полицитидиловая кислота (Poly I:C) - синтетический, двухспиральный полирибонуклеотид, который может производить действие, подобное вирусному. Введение Poly I:C, подобно NDV, производит быструю (в пределах 1-2 часов) активацию HPA оси (544, 716). Хотя сушествует лишь несколько исследований ответа HPA ответа на Poly I:C, очевидно, что CRF - важный медиатор этого ответа, потому что индуцированное Poly I:C увеличение плазменой концентрации кортизола у кролика, подавлялось моноклональными антителами к CRF (544). Кроме того, существенное увеличение плазменных уровней кортикостерона в ответ на Poly I:C наблюдаемое у нормальных мышей, полностью отсутствует у IL-6-дефицитных мышей (716), указывая, что индуцированная Poly I:C активация HPA оси зависит от производства цитокина IL-6.
3. Мышиный вирус цитомегалии (MCMV)
Вирусы цитомегалии (CMV) - вирусы герпеса, которые являются серьезной проблемой у пациентов со СПИД, при трансплантации органов и являются наиболее частой вирусной причиной врожденных ненормальностей. Мышиный CMV (MCMV) эффективно инфицирует мышей. Недавние исследования Ruzek с коллегами (716) показали, что MCMV стимулирует увеличение уровней IL-12, IFN-gamma, TNF-alpha, IL-1alpha и IL-6, но не IL-1beta через 24-48 часов после инфицирования. В течение этого времени наблюдается существенное увеличение плазменной концентрации кортикостерона и меньшее, но статистически значимое увеличение плазменной концентрации АКТГ (716). Увеличение уровня кортикостерона у инфицированных MCMV мышей, у нормальных мышей, которым вводились антитела к IFN-gamma или у IFN-gamma-дефицитных мышей, сопоставим с ответом у мышей группы контроля, инфицированных MCMV (716). Однако, IL-1 и IL-6 играют важную роль в активации HPA оси. Ответ на MCMV заметно ослаблен у нормальных мышей, которым вводился IL-1ra или у IL-6-дефицитных мышей, без любой терапии, существенно влияющей на вирусную массу. Увеличенные уровни IL-6, произведенные MCMV инфекцией существенно уменьшаются, когда мышам вводится IL-1ra, принимая во внимание, что уровни IL-1alpha у IL-6-дефицитных мышей обычно увеличены (716). Авторы заключили, что IL-6 - основной цитокин, участвующий в активации HPA оси в ответ на MCMV и что IL-1alpha играет вторичную роль, способствуя увеличению производства IL-6 (716).
B. Эндотоксины
Эндотоксины - липополисахариды (LPS), элементы клеточной мембраны грамм-отрицательных бактерий, которые появляются при лизисе бактерии. Введение очищенных препаратов LPS производит остро-фазовый ответ на грамм-отрицательную инфекцию без инфицирования хозяина (123). Поэтому, введение бактериальных эндотоксинов лабораторным животным было наиболее часто используемой моделью для изучения механизмов, лежащих в основе нейроэндокринного ответа на бактериальную инфекцию и сепсис (214, 863, 883).
Хотя мыши и крысы относительно нечувствительны к LPS по сравнению с многими другими видами (включая людей), внутривенное введение LPS грызунам производит существенное увеличение секреции АКТГ и кортикостерона в пределах 30-60 мин. Необходимо подчеркнуть, что количественно, физиологические ответы на LPS могут отличиться в зависимости от его источника и способа подготовки (345). Мы обнаружили, что ~5 µg/kg LPS (Escherichia coli, серотип O26:B6; партия 20H4025) производит пиковое увеличение плазменой концентрации АКТГ 500-1,000 pg/ml (по сравнению с < 20 pg/ml в группе контроля) через 90-120 минут после внутривенного введения у здоровых самцов крыс (889). Аналогично, LPS стимулирует секрецию АКТГ и кортикостерона у мышей и активация оси HPA может наблюдаться и у крыс и у мышей после внутривенного или интраперитонеального введения LPS. Однако, точные механизмы, посредством которых эти способы введения LPS влияют на HPA ось, могут существенно различаться (144, 925).
Кроме увеличенных уровней АКТГ и кортикостерона, сообщалось о других индексах активации HPA оси в ответ на LPS. Внутривенное или интраперитонеальное введение LPS увеличивает экспрессию мРНК c-fos или белка Fos и гяРНК или мРНК CRF в pPVN (230, 387, 456, 680, 718, 924, 925). Крысы, у которых было повреждено PVN, могли производить обнаружимые плазменные уровни АКТГ на чрезвычайно большую дозу LPS (2 милиграмма / кг интраперитонеально), но его величина была заметно меньше (227), указывая, что PVN играет основную роль в индуцированном LPS увеличении плазменых уровней АКТГ. Действительно, очевидно, что CRF является важным медиатором индуцированной LPS секреции АКТГ. Это подтверждается увеличенной секрецией CRF ME после введения LPS (292) и существенным ослаблением или ингибированием индуцированной LPS секреции АКТГ, произведенной очень большими дозами LPS (2.5 милиграмм / кг интраперитонеально) или большим количеством умеренных доз (2.5 µg/kg интраперитонеально или 50 µg/kg внутривенно), соответственно (25, 750).
Эти действия LPS на HPA ось in vivo происходят не из-за прямого фармакологического взаимодействия LPS с тканями HPA оси. Липополисахарид не имеет никакого эффекта или подавляющего действия на секрецию CRF гипоталамными эксплантатами (545, 581, 652) или секрецию АКТГ культурой клеток гипофиза крысы (117, 886). Также маловероятно, что LPS увеличивает АКТГ ответ гипофиза на CRF, так как LPS уменьшает экспрессию рецепторов CRF в гипофизе и in vivo и in vitro (25) и секреция АКТГ культурой клеток гипофиза крысы, при стимуляции CRF не подвержена действию LPS (886). Кроме того, мыши (линия C3H/HeJ) с дефицитом производства IL-1 в ответ на LPS (373, 759, 856) имеют заметно меньшее увеличение плазменной концентрации АКТГ и кортикостерона после интраперитонеального введения LPS (216), предполагая что IL-1 является важным медиатором эффектов LPS. Липополисахарид - мощный индуктор синтеза и секреции множества цитокинов (см. секцию IC). В частности цитокины IL-1, IL-6 и TNF-alpha - вероятные медиаторы эффектов LPS на нейроэндокринную секрецию (863).
После введения LPS непосредственно в кровоток, плазменные концентрации каждого из этих трех цитокинов последовательно увеличивается, сначала TNF-alpha, затем IL-1beta и наконец IL-6 (174, 189, 290). Секреция этих трех цитокинов связана не только временным фактором, также имеются свидетельства, что они также связаны причинно. Введение антител к TNF-alpha ослабляет секрецию IL-1 и IL-6 в ответ на LPS (263), принимая во внимание, что нейтрализация IL-1 (487) или частое введение больших доз IL-1ra (494) аннулирует индуцированную LPS секрецию IL-6. После местного введения LPS (например, интраперитонеально или подкожно), местные концентрации всех трех цитокинов также увеличиваются. Однако, их уровни в крови зависят от степени прониконовения в общее кровообращение. В периферической крови увеличивались только уровни IL-6 (541, 542, 844, 998). Местное введение IL-1ra на участке введения LPS аннулирует увеличение плазменных уровней IL-6 (541), предполагая причинную связь между производством IL-1 и IL-6 после введения LPS. В свете этих данных, удивительно, что недавние эксперименты показали, что плазменный ответ IL-6 на LPS был нормальным у IL-1beta (10, 1001) или IL-1R1 (463) дефицитных мышей. Указывает ли это на важную роль для IL-1alpha (или IL-1gamma) и IL-1R2 (или новых рецепторов IL-1) необходимо исследовать.
Сравнение временного профиля производства цитокинов и активации HPA оси в ответ на LPS, дало противоречивые данные. После внутриартериального введения LPS, концентрации TNF-alpha, IL-1beta и IL-6 в плазме отставали от увеличения плазменного уровня АКТГ, независимо от дозы LPS (290). Однако, после внутривенного введения низких доз LPS, увеличение плазменных уровней TNF-alpha совпадало с секрецией АКТГ, принимая во внимание, что в более высоких дозах, увеличение плазменого уровня TNF-alpha происходит после начального повышения плазменного уровня АКТГ (223). Мы обнаружили, что после введения LPS (5 µg/kg внутривенно), увеличение уровня TNF-alpha в крови предшествует увеличению уровня АКТГ; время начала увеличения и пик концентрации TNF-alpha происходили на 15 минут раньше момента начала увеличения и пика концентрации АКТГ (889).
Важность цитокинов в АКТГ ответе на LPS была сначала была подтверждена обнаружением ингибирования ответа, когда мышам предварительно вводились антитела к рецепторам IL-1 (690). Дальнейшие исследования показали, что деструкция макрофагов производила существенное уменьшение уровней IL-1 в ответ на высокую дозу LPS (2.5 милиграмма / кг внутривенно) и уменьшала на 40 % АКТГ ответ на небольшую дозу LPS (2.5 µg/kg внутривенно) (195). Введение антител к рецепторам IL-1 мышам (640) или IL-1ra крысам (223, 752), уменьшает АКТГ ответ на внутривенное или интраперитонеальное введение LPS. Участок действия IL-1 на ЦНС был предположен при экспериментах, показавших, что интрацеребровентрикулярная инфузия IL-1ra ингибирует увеличение мРНК CRF в PVN крыс спустя 8 часов после интраперитонеального введения LPS (387).
Хотя вышеупомянутые результаты указывают на цитокин IL-1, как на медиатор активации HPA оси LPS, не все исследования поддерживают эту гипотезу. Например, у мышей, которым интраперитонеально вводился IL-1ra, в дозе, которая ингибировала кортикостероновый ответ на IL-1alpha или IL-1beta, не ингибировала кортикостероновый ответ на LPS (213). Кроме того, использование трансгенных линий мышей, с дефицитами различных компонентов системы IL-1, подняло интересные вопросы относительно требования обязательного участия IL-1 в остро-фазовом ответе на LPS. Например, лихорадка в ответ на LPS ингибировалась антителами к IL-1beta (418, 461, 487) или IL-1ra (494, 791), ясно указывая на участие IL-1 в патогенезе лихорадки, индуцированной LPS. Однако, IL-1beta-дефицитные мыши демонстрируют лишь немного уменьшенную (10) или даже увеличенную (438) лихорадку в ответ на интраперитонеальное введение LPS. Аналогично, хотя IL-1beta участвовал в индукции производства IL-6 и кахексии после введения LPS, ни один из этих ответов не ингибировался у IL-1beta-дефицитных мышей (10, 247, 250, 438, 1001). Исследования IL-1r1-дефицитных мышей показали, что IL-1r1 является необходимым для всех событий, медиатором которых является IL-1 (лихорадка, индукция IL-6, индукция E-селектина) (442), но при этом мыши имеют нормальный ответ в виде лихорадки и кахексии, индуцированные интраперитонеальным введением LPS (442, 463). Поэтому не удивительно, что исследования ответа HPA оси на LPS у трансгенных мышей также не смогли подтвердить роль IL-1 в ответе HPA оси на LPS (10, 247, 250).
Исследования эффекта иммунонейтрализации IL-6 и TNF-alpha также предположили физиологическую роль этих цитокинов в ответе HPA на LPS. Хотя нейтрализация IL-1, IL-6 или TNF-alpha аннулирует АКТГ ответ на большие дозы LPS у мышей, Perlstein с коллегами (640) обнаружили, что только антитела к IL-6 были эффективны для уменьшения плазменной концентрации АКТГ в ответ на низкие дозы LPS у мышей. Напротив, IL-6-дефицитные мыши демонстрируют нормальный плазменный кортикостероновый ответ на высокую дозу LPS (1 милиграмм / кг интраперитонеально) (254). У крыс, антитела к TNF-alpha ингибируют плазменный АКТГ ответ на низкие и высокие дозы внутривенного LPS (223, 889), принимая во внимание, что TNF-r1-дефицитные мыши демонстрируют нормальный кортикостероновый ответ на интрацеребровентрикулярное введение LPS (2.5 µg).
Из вышеупомянутого обсуждения очевидно, что точная роль, IL-1, IL-6 и TNF-alpha в ответе HPA ответа на LPS полностью не ясна. Каждый из этих трех цитокинов влияет на синтез и секрецию других и каждый из них способен усиливать эффект других. Возможно, избыточность каждого их этих цитокинов вносит вклад в отсутствие ясности результатов описанных исследований. В целом, однако, представленные свидетельства указывают, что в зависимости от парадигмы эксперимента, один или несколько из цитокинов IL-1, IL-6 или TNF-alpha, могут вносить вклад в секреторный ответ HPA оси на LPS.
C. Местное воспаление
Множество исследований изучало механизмы, посредством которых острое местное воспаление производит активацию HPA оси (169, 879, 881, 884, 965). Наиболее часто используемая модель состоит из подкожного или внутримышечного введения скипидара мышам или крысам. Введение скипидара производит локальное воспаление, которое характеризуется четким абсцессом, центральным некрозом и увеличенной проницаемостью сосудов (476, 620, 829, 978). Эта парадигма использовалась, чтобы исследовать множество остро-фазовых ответов на местное воспаление, включая лихорадку, гиперметаболизм, синтез цитокинов, белковый метаболизм, анорексию, нейроэндокринные изменения и синтез белков острой фазы печенью (27, 167-169, 247, 286, 432, 603, 965, 978, 1001).
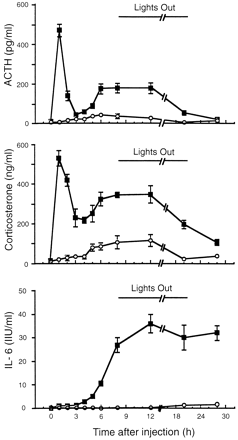
У крыс, внутримышечное введение скипидара производит активацию HPA оси, состоящую из двух фаз (рис. 2). Увеличение секреции АКТГ вскоре после введения скипидара, происходит не из-за активации ноцицептивного сенсорного афферента (879) и связано с синтезом или секрецией цитокинов (247, 254). Через 3 часа после введения скипидара, плазменная концентрация АКТГ возвращается уровням группы контроля (рис. 2). Это сопровождается вторым увеличение плазменной концентрации кортикостерона и АКТГ, которое продолжается параллельно с развитием местного воспаления в течение ~24 часов и сопровождается ответом HPA оси на местное воспаление per se (884). Индуцированное введением скипидара воспаление производит длительное (по крайней мере 12 часов) увеличение экспрессии Fos в PVN (696) и второе увеличение плазменной концентрации АКТГ, которое полностью ингибируется введением антител к CRF (884), указывая важность гипоталамного CRF в АКТГ ответе.

Рис.2. Плазменные концентрации АКТГ, кортикостерона и IL-6 у крыс после внутримышечного введения 50 µl/100 g веса тела солевого раствора (белые круги) или скипидара (черные круги). Turnbull и Rivier (884)
Генерация и роль цитокинов в течение остро-фазового ответа, произведенного введением скипидара, были подробно изучены. Индуцированное скипидаром местное воспаление производит существенное увеличение плазменных уровней IL-6, но не IL-1 или TNF-alpha (167, 248, 495, 881). Однако, концентрация IL-1 увеличена на участке местного воспаления, индуцированного скипидаром (248) и ингибирование активности TNF-alpha (167) или IL-1 (286, 495, 879) заметно уменьшает уровни IL-6 в крови, предполагая что оба этих цитокина стимулируют секрецию IL-6 на участке местного воспаления. Хотя IL-1beta или IL-1R1-дефицитные мыши демонстрируют нормальный IL-6 ответ на LPS, плазменный IL-6 ответ на скипидар полностью отсутствует у мышей обоих этих линий (463, 1001). Интересно, что ICE-дефицитные мыши не могут производить зрелый IL-1beta в ответ на LPS (469), но демонстрируют нормальное производство зрелого IL-1beta и нормальный плазменный IL-6 ответ при введении скипидара (248). Эти данные ясно указывают, что при системном (LPS) и местном воспалении (скипидар), действуют различные молекулярные механизмы индукции IL-1beta и IL-6 ответа.
Было показано, что IL-6 является обязательным медиатором множества ответов на местное воспаление, индуцированное скипидаром, включая лихорадку, кахексию и увеличение синтеза белков острой фазы печенью (87, 247, 254, 432, 437, 603). Поскольку IL-6 - единственный цитокин, существенное количество которого было обнаружено в большом круге кровообращения после введения скипидара, кажется вероятным, что он является главным сигналом для мозга. Однако, было получено мало данных, указывающих, что IL-6 участвует в ответе HPA на скипидар. Плазменные концентрации IL-6 хорошо коррелируют со вторым увеличением плазменных уровней АКТГ и кортикостерона (879, 884) (см. рис. 2), которые как известно, усиливают действие IL-6 на секреторную активность HPA оси (327, 499, 519, 520, 527, 574, 575, 809), что позволяет предположить, что IL-6 является вероятным циркулирующим медиатором нейроэндокринного ответа на скипидар (879, 884). Однако, одно сообщение показывает, что иммунонейтрализация системного IL-6 не влияет на увеличение плазменных уровней кортикостерона у мышей 12 часов после введения скипидара (603). Должно быть отмечено, что в этом исследовании (603), введение антител к IL-6 привело к увеличению, но не к уменьшению биологической активности IL-6 в плазме, о чем сообщалось ранее (760). Исследования IL-1beta - и IL-6-дефицитных мышей показали, что ни IL-1beta ни IL-6 не являются обязательными медиаторами увеличения плазменной концентрации кортикостерона вскоре (1.5-2 часа) после введения скипидара (247, 254). Однако, точка времени, выбранная для исследования этими авторами, соответствует начальному увеличению секреторной активности HPA оси, связанному с болью (рис. 2), и никаких наблюдений не было сделано в более поздних точках времени, соответствующих ответу HPA оси на местную воспалительную реакцию (6-24 часа). Недавно мы получили данные, которые указывают, что IL-6 - важный медиатор ответа HPA оси на местное воспаление (A. V. Turnbull, S. J. Hopkins, S. Prehar и C. L. Rivier, неопубликованные данные). Через 9-12 часов после введения скипидара, когда плазменные уровни IL-6 максимально увеличены в группе контроля (рис. 2), IL-6-дефицитные мыши демонстрируют заметно уменьшенный (на две трети) кортикостероновый ответ (рис. 3). Эти данные вместе с уменьшением лихорадки (437), синтеза белков острой фазы (432) и кахексии (432, 437) у IL-6-дефицитных мышей, указывают, что IL-6 - важный циркулирующий медиатор при местном воспалении, действует как сигнал ''SOS'' и стимулирует разнообразные остро-фазовые ответы.
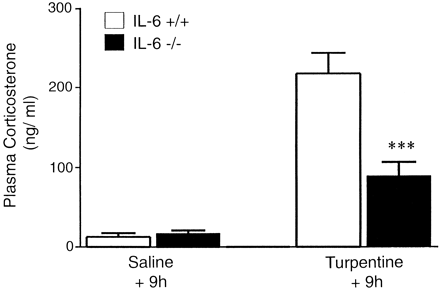
Рис. 3. Влияние индуцированного скипидаром местного воспаления на плазменные уровни кортикостерона у самцов мышей дикого типа (IL-6 +/+) или IL-6-дефицитных мышей (IL-6 -/-). Образцы плазмы были взяты через 9 часов после введения скипидара или солевого раствора. *** P < 0.002 (A. V. Turnbull, S. J. Hopkins, S. Prehar и C. L. Rivier, неопубликованные данные) .
Также имееются свидетельства участия других цитокинов в этом ответе. Хотя внутримышечное введение скипидара крысам не увеличивает уровни мРНК IL-1beta, IL-6 или TNF-alpha в пределах ЦНС или гипофиза, интрацеребровентрикулярное введение антител к TNF-alpha или растворимых рецепторов TNF-alpha, приводят к заметному ингибированию секреции АКТГ через 6-9 часов после введения скипидара (881). Это указывает на важную, но пока еще необъясненную роль мозгового TNF-alpha в этом ответе. Степень, с которой другие цитокины в ЦНС могут вносить вклад в увеличенную секреторную активность HPA оси, пока неизвестна.
D. Физический и психологический стресс
Индукция производства цитокинов не ограничена воспалительными и инфекционными факторами. Недавние исследования показали, что секреция IL-1, IL-6 и нейротрофического фактора мозга (BDNF) изменяются в течение острого физического или психологического стресса (462, 536, 546, 777, 778, 797, 1002). Например, плазменные уровни IL-6 увеличены у крыс при воздействии новой окружающей среды (462, 561), факторов, вызывающих отвращение (1002), электрошока (883, 1002) или при лишении свободы (1002). Кроме того, уровни мРНК IL-6 увеличены в среднем мозге и уровни мРНК IL-6R уменьшены в среднем мозге и гипоталамусе у крыс через 4-24 часа после стресса, вызыванного ограничением свободы (779), принимая во внимание, что иммобилизация увеличивает плазменную концентрацию IL-6 и увеличенную эксперссию мРНК IL-6 в печени и селезенке у мышей (417). У людей, плазменные уровни IL-6 быстро увеличиваются после монотоной физической нагрузки с пиками через 15 и 45 минут (622). Увеличение плазменных уровней IL-6 после физического и/или психологического стресса у крыс происходит намного более быстро (в пределах 15 минут), чем наблюдаемое после инициирования местного (скипидар, 2-3 часа) или системного (LPS, 45-60 минут) воспаления и возможно связано с действием катехоламинов (196, 800, 852, 910). Однако, увеличенные уровни крови IL-6 непосредственно не вносят вклад в ответ HPA оси на острый стресс, так как увеличение плазменных уровней IL-6 уровни небольшое; хотя плазменные уровни IL-6 увеличиваются быстро, они отстают от плазменных уровней АКТГ (883, 1002). Кроме того, Ruzek с коллегами (716) сообщили, что IL-6-дефицитные мыши демонстрируют увеличение плазменных уровней кортикостерона в ответ на иммобилизацию и подчеркнули, что это эффект был сопоставим с мышами дикого типа.
Сообщалось, что лишение свободы или иммобилизация, увеличивали гипоталамные уровни мРНК IL-1beta (546, 828), IL-1 (778) и мРНК IL-1ra (828) в течение 30 минут. Кроме того, хронический физический / психологический стресс увеличивает и плазменную концентрацию IL-1beta у крыс (536) и людей (814) и гипоталамные уровни мРНК IL-1beta у мышей (837). Так как у крыс при интрагипоталамном введении IL-1ra происходит существенное уменьшение АКТГ ответа на иммобилизацию, была предположена роль IL-1 в регулировании ответа HPA оси на стресс, не связанная с инфекцией или воспалением (777, 778). Действительно, другие исследования показали, что интрацеребровентрикулярное введение IL-1ra перед шоком, блокирует последующие действия с целью спасения и состояние страха, обычно производимого таким стрессором (511), предполагая, что IL-1 может иметь некоторые поведенческие эффекты.
Данные, что цитокины могут быть быстро (в пределах нескольких минут) произведены в ответ на стимул, который не приводит к повреждению ткани или инфекцие, позволяют предположить роль цитокинов в гомеостазе, которая ранее не была известна. Должно быть указано, что многие из физиологических ответов на воспалительные / инфекционные стрессоры и психологические / физические стрессоры являются общими (например, активация HPA оси, подавление репродукции, изменения поведения, лихорадка и уменьшение аппетита). Действительно, психологический / физический стресс производит многие аспекты остро-фазового ответа. Кроме того, хотя люди испытывают психологический / физический стресс обычно без присутствия воспалительного / инфекционного стресса, психологический / физический стресс обычно предшествует воспалительному / инфекционному стрессу у животных в дикой природе (например, взаимодейстие хищник-добыча, нехватка пищи / воды). То, что быстрое производство цитокинов может вносить вклад в нейроэндокринный ответ на психологические / физические стрессоры (778) говорят, что ответы на такие стрессоры не могут заметно отличиться от ответов на воспалительные / инфекционные стрессоры.
E. Гипоталамо-гипофизо-надпочечная активность в отсутствие стресса
Возможно даже более удивительны, чем роль цитокинов в регулировании ответ HPA оси на невоспалительное и неинфекционные стрессы, являются недавно полученные данные, что цитокин LIF может вносить вклад в регулирование секреции HPA оси в нестрессовом состоянии. Хотя ингибирование IL-1, IL-6 или TNF-alpha существенно не изменяют нестрессовые плазменные уровни АКТГ или кортикостерона, исследования Melmed с коллегами (6, 7, 667, 926) продемонстрировали, что член семейства gp130 цитокинов, LIF, играет важную роль в регулировании секреции АКТГ. LIF-дефицитные мыши имеют более низкие нестрессовые плазменные уровни АКТГ, чем мыши дикого типа, причем этот эффект может быть полностью изменен экзогенным LIF (6). Это говорит, что LIF важен для развития и созревания HPA оси или что LIF является тонизирующим средством, усиливающим секрецию АКТГ у взрослых животных.