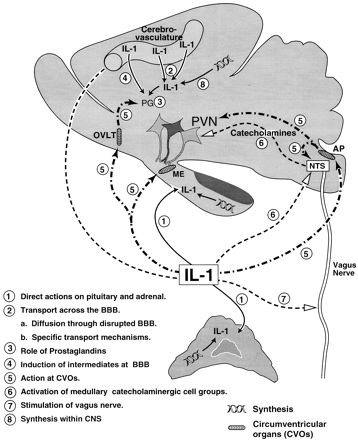
V. МЕХАНИЗМЫ АКТИВАЦИИ ГИПОТАЛАМО-ГИПОФИЗО-НАДПОЧЕЧНОЙ ОСИ IL-1
Предыдущее обсуждение показало способность множества цитокинов различных семейств влиять на активность HPA оси. Кроме того, распределение различных цитокинов и их рецепторов во всем мозге, гипофизе и, в меньшей степени, в надпочечниках, дают анатомическое основание гипотезе, что цитокины влияют на функцию этих органов. Однако, прямых свидетельств, что рецепторы цитокинов, и в частности рецепторы IL-1, экспрессированы у секреторных клеток (CRF нейроны гипофиза, нормальные кортикотрофы, адренокортикальные клетки, производящие GC), мало. Это заставило предположить участие структурных и/или фармакологических промежуточных звеньев в активации HPA оси цитокинами. Исследования, нацеленные на объяснение механизмов, посредством которых цитокины могут активизировать HPA ось при специфической угрозе гомеостазу, сосредоточились на цитокине IL-1 и в меньшей степени на IL-6 и TNF-alpha. В следующих секциях обсуждаются возможные анатомические и фармакологические пути, посредством которых IL-1, произведенный в ответ на специфическую угрозу гомеостазу, может влиять на HPA ось (рис. 4). Исследования, описанные в секции IV указывают, что ЦНС - вероятно первичная цель для IL-1 при выявлении увеличенной секреторной активности HPA оси. Поскольку не ясно, как действия IL-1 в мозге связаны с остро-фазовыми ответами, такими как лихорадка, усиление метаболизма, кахексия, подавление репродукции и нарушение поведения, приводятся данные, полученные в этих исследованиях, где это уместно. Кроме того, также обсуждаетмя информация, доступная для других цитокинов, в частности IL-6 и TNF-alpha.

1. Прямые действия на гипофиз и надпочечники
2. Транспорт через гематоэнцефалический барьер
a. диффузия при увеличении проницаемости гематоэнцефалического барьера
b. специфические транспортные механизмы
3. Роль простагландинов
4. Индукция посредников на внутренней поверхности гематоэнцефалического барьера
5. Активация циркумвентрикулярных органов
6. Активация катехоламинергических медуллярных групп клеток
7. Стимуляция блуждающего нерва
8. Синтез в пределах ЦНС
AP - самое заднее поле (area postrema)
BBB - гематоэнцефалический барьер;
CVO - циркумвентрикулярные органы (circumventricular organs)
МЕ - срединное возвышение (median eminence);
OVLT - сосудистая сеть терминальной пластинки (organum vascularis of the lamina terminalis)
PVN - паравентикулярное ядро
CNS - центральная нервная система
NTS - ядро одиночного пути (nucleus tractus solitarius)
Рис 4. Возможная модель влияния IL-1 на секреторную активность гипоталамо-гипофизо-надпочечной оси.
A. Прямое действие на гипофиз и надпочечники
Большинство данных, полученных in vivo указывают, что возбуждение секреции АКТГ гипофизом и GC надпочечниками в ответ на IL-1, производится субстанциями, увеличивающими секрецию АКТГ, в частности CRF. Это доказыватся существенным уменьшением плазменной концентрации АКТГ и кортикостерона при иммунонейтрализации CRF. Однако, наблюдалось неполное ингибирование секреции АКТГ или кортикостерона после иммунонейтрализации CRF (909). Кроме того, существенное увеличение плазменной концентрации кортикостерона было отмечено даже когда секреция АКТГ, произведенная IL-1, заметно уменьшилась (390). Однако, окончательных доказательств, что CRF был полностью иммунонейтрализован или что остаточная секреция АКТГ не способна производить существенное увеличение плазменной концентрации кортикостерона, нет. Хотя плазменная концентрация АКТГ может быть увеличена до 1,000 pg/ml при внутривенном введении IL-1beta, намного более низкие уровни АКТГ (100-200 pg/ml) являются достаточными для стимулирования максимальной секреции кортикостерона. Действительно, надпочечники крыс и собак отвечали на очень небольшое увеличение (< 10 pg/ml) плазменой концентрации АКТГ с существенными увеличением плазменных уровней GC (388, 405, 975).
Данные, обсужденные в секции IV указывают, что множество цитокинов, и IL-1 в частности, способны производить прямые действия на гипофиз, увеличивая секрецию АКТГ и на кору надпочечников, увеличивая секрецию GC. Рецепторы IL-1 - были обнаружены в передней доле гипофиза, хотя маловероятно, что они экспрессированы у нормальных кортикотрофов. Гипофиз и надпочечники подвергаются действию IL-1, если его концентрация в крови увеличена (например, при наличии эндотоксинов в крови). Кроме того, IL-1 может синтезироваться местно, в пределах этих тканей. Однако, как обсуждалось выше, для выявления секреции АКТГ или GC гипофизом и надпочечниками, соответственно, необходимо продолжительное воздействие IL-1. Поэтому, прямое действие IL-1 на гипофиз или надпочечники не могут объяснить существенный компонент секреции гормонов, которая наблюдается в ответ на кратковременное воздействие IL-1 in vivo. Напротив, обстоятельства, приводящие к длительному увеличению уровней цитокинов, например, хроническое воспаление (732, 818), могут хорошо объяснять прямое действие IL-1 или других цитокинов на секрецию АКТГ гипофизом и/или GC надпочечниками. Кроме того, увеличенный синтез IL-1 гипофизом или надпочечниками могут регулировать рост этих желез (21, 669, 819, 1004). Аналогично, множество других интерлейкинов (например, IL-2, IL-6) и факторов роста (например, EGF) влияют на рост гипофиза или надпочечников (20, 21, 157, 637).
Большое число данных указывают, что влияние IL-1 на активность HPA оси происходит прежде всего на уровне гипоталамуса. Причем это не зависит от того, вводился ли IL-1 непосредственно в мозг или на периферии. Это поднимает вопрос, каким образом, переносимый кровью большой пептид IL-1, поступает в ЦНС. Модели, которые были предложены для разъяснения этого вопроса, обсуждаются ниже. Они включают возможность, что IL-1 проникает через гематоэнцефалический барьер (см. секцию VB), что IL-1 стимулирует производство сигналов в коре мозга (см. секцию VC), действует на гематоэнцефалический барьер (см. секцию VD), проникает через области мозга, лишенные гематоэнцефалического барьера (см. секцию VE), проникает через группы клеток ствола мозга (см. секцию VF) или через периферические афферентные нервы (см. секцию VG). Гипотеза, что IL-1, произведенный в пределах самого мозга производит активацию HPA оси, также рассматривается (см. секцию VH). Наконец, возможность, что увеличенная местная секреция IL-1 в поврежденной ткани может косвенно активизировать HPA ось, стимулируя синтез и секрецию циркулирующих факторов, также обсуждается (см. секциюVI).
B. Проникновение цитокинов в мозг
Транспорт растворов из сосудов в периваскулярную ткань (или наоборот) происходит посредством парацеллюллярных или трансцеллюллярных механизмов. В отношении цереброваскуляных сосудов, парацеллюллярный механизм маловероятен из-за присутствия гематоэнцефалического барьера. Гематоэнцефалический барьер состоит из нефенестрированных эндотелиальных клеток, которые связаны соединительными комплексами и таким образом формируют непрерывный слой клеток, который имеет свойства непрерывной плазменной мембраны (664). Поэтому, парацеллюллярная ультрафильтрация растворов в ткани и из тканей, которая происходит в периферических сосудах, не происходит в большинстве цереброваскулярных регионах, по крайней мере пока гематоэнцефалический барьер остается неповрежденным. Кроме того, большая молекулярная масса (8-65 kDa) и гидрофильный характер цитокинов, устраняет возможность трансцеллюллярного транспорта с помощью механизма диффузии. Действительно, ранние исследования заключили, что гематоэнцефалический барьер непроницаем для IL-1 (85, 161, 204). Однако, парацеллюллярный транспорт цитокинов может происходить, когда целостность гематоэнцефалического барьера нарушена (см. секцию VB1) и впоследствии были описаны трансцеллюллярные механизмы транспорта различных цитокинов (см. секцию VB2).
1. Цитокины и целостность гематоэнцефалического барьера
Нарушение целостности гематоэнцефалического барьера может происходить при воспалительных болезнях мозга, таких как болезни ЦНС (рассеянный склероз, менингит, опухоли мозга, деменция при СПИД), травма мозга, цереброваскулярные повреждения или приступы (368). Кроме того, введение больших доз LPS может увеличивать проницаемость гематоэнцефалического барьера (91, 199, 483, 496, 781, 878). Подобное нарушение целостности гематоэнцефалического барьера делает возможным не только проникновение больших пептидов, таких как цитокины, но также и увеличивает проницаемость для клеток, таких как макрофаги, моноциты, лимфоциты и нейтрофилы, которые способны к синтезу цитокинов, но чье проникновение в нормальный, здоровый мозг ограничено.
Связь между воспалительными событиями на периферии и производством цитокинов в ЦНС, вела к множеству исследований, изучавших возможное влияние цитокинов на проницаемость гематоэнцефалического барьера. В однослойных культурах эндотелиальных клеток мозга, LPS, IL-1beta, IL-6 и TNF-alpha производили постоянное уменьшение трансэндотелиального электрического сопротивления, что указывает на увеличение проницаемости гематоэнцефалического барьера (199, 200). Исследования in vivo продемонстрировали, что интрацеребровентрикулярное введение TNF-alpha увеличивает проницаемость гематоэнцефалического барьера у крыс (413) и свиней (535) и увеличенное производство TNF-alpha в мозге, было связано с увеличенной проницаемостью гематоэнцефалического барьера при множестве воспалительных болезей ЦНС (768, 769, 780). Способность системного введения цитокинов (IL-1alpha, IL-1beta, IL-2, IL-6, TNF-alpha) влиять на проницаемость гематоэнцефалического барьера обсуждалась (33, 229, 413, 719). Кроме того, эксперименты продемонстрировали увеличение проницаемости гематоэнцефалического барьера после периферического введения чрезвычайно высоких доз LPS (483) или после длительного введения LPS (496). Поэтому, увеличение проницаемости гематоэнцефалического барьера в результате серьезной периферической инфекции, может позволять цитокинам самостоятельно, или клеткам производящим цитокины, проникать в ЦНС. Однако, ясно, что начальные нейроэндокринные эффекты при периферическом введении цитокинов или LPS, наблюдаются более быстро и в более низких дозировках, чем может быть объяснено нарушением целостности гематоэнцефалического барьера.
2. Транспорт цитокинов через гематоэнцефалический барьер
Работа Banks с коллегами (34) показала, что транспорт цитокинов в мозг возможен, даже когда когда целостность гематоэнцефалического барьера не нарушена. Транспортные механизмы были описаны для IL-1alpha (35), IL-1beta (37), IL-1ra (309), IL-6 (36) и TNF-alpha (308), но не для IL-2 (923), с помощью введения мышам меченных 125I цитокинов внутривенно и измерения радиоактивности во всем мозге, мозге, очищенном от крови, ЦСЖ или гомогенатов мозговой паренхимы. Должно быть отмечено, что при используемых дозировках цитокинов, нарушение целостности гематоэнцефалического барьера не происходило, что проявлялось низкими и неизменными уровнями прооникновения меченного 125I альбумина в ЦНС. Не все меченные радиоактивным 125I молекулы, найденные в мозге после внутривенного введения цитокинов были идентифицированы как подлинные цитокины при хроматографии. В частности только 16 % помеченного 125I IL-6 в паренхиме мозга после внутривенного введения было неповрежденным (36), что поднимает вопрос, какое количество IL-6 в мозге фактически остается биологически активным. Члены семейства IL-1, IL-1alpha, IL-1beta и IL-1ra имеют общий транспорт (309, 647), но проникновение IL-6 в мозг не ингибируется присутствием немеченого IL-1alpha или TNF-alpha (36), принимая во внимание, что исследования конкурирования IL-1alpha, IL-1beta, IL-6 и MIP-1alpha, показали селективность транспорта TNF-alpha (308).
Banks с коллегами (34) обнаружили, что в каждом грамме ткани мозга можно обнаружить от 0.05 до 0.3 % полной дозы меченного 125I IL-1alpha, IL-1beta, IL-1ra, IL-6 или TNF-alpha через 20-60 минут после их внутривенного введения. Многие исследователи сомневаются, является ли такое количество цитокинов в мозге физиологически существенным (678, 711, 943). Действительно, кажется маловероятным, что такая небольшая часть цитокинов, попадая в мозг, может производить быстрые эффекты, подобные наблюдаемым после внутривенного введения рекомбинантных цитокинов. Кроме того, маловероятно, что транспорт IL-1 через гематоэнцефалический барьер может объяснить действие IL-1 на HPA ось при введении на периферии, так как паттерн экспрессии генов нейропептидов, экспрессия cIEG и профиль секреции АКТГ заметно отличаются при введении IL-1 в мозг и на периферии (см. секции IIA и IVA3). Однако, такие транспортные механизмы могут играть существенную роль, когда периферические уровни эндогенных цитокин увеличены в течение продолжительных периодов времени. Это характерно для хронического воспаления, когда плазменные уровни IL-6 могут оставаться увеличенными в течение длительных периодов (от часов до недель).
C. Роль посредников
Очевидное отсутствие рецепторов IL-1 в пределах нейронных элементов pPVN и ограниченное проникновение IL-1 в ЦНС, вело к гипотезе, что IL-1 стимулирует HPA ось посредством увеличения производства посредников, которые непосредственно взаимодействуют с гипоталамными нейросекреторными процессами. Эти посредники включают классические нейромедиаторы, такие как катехоламины (см. секцию VF), серотонин (285, 477, 478), гистамин (293, 421, 638), эйкосаноиды и окись азота (NO) (см. секцию VC2).
1. Эйкосаноиды
Эйкосаноиды формируются при метаболизме арахидоновой кислоты. Лимитирующим шагом при производстве эйкосаноидов является преобразование арахидоновой кислоты в PGH2 ферментом циклооксигеназой (COX; также известным как PGH синтаза / циклооксигеназа и PG синтаза эндопероксидаза). Были охарактеризованы две формы COX: повсеместно экспрессированная форма (COX-1) и вторая форма (COX-2), которая может быть индуцирована различными факторами, включая митогены, гормоны, и, что наиболее интересно для этого обсуждения, цитокинами (374, 406, 609, 980, 985). Преобразование PGH2 специфическими синтазами производит три семейства эйкосаноидов: простагландины (PG), тромбоксиназы (Tx) и простациклины. Роль PG в активации HPA оси цитокином IL-1 особенно хорошо изучена в значительной степени из-за признания, что PG - важный медиатор действия IL-1 в большинстве изученных периферических тканей (343).
Простагландины проявляют влияние на секреторную активность HPA оси на различных уровнях. У крыс, увеличение плазменной концентрации АКТГ наблюдается в пределах 10 минут после внутривенного введения PGE1, PGE2 или PGF2alpha, но не PGD2 (560, 580, 928, 935). Аналогично, увеличение плазменной концентрации АКТГ происходит при введении PGE2 в несколько участков мозга, включая преоптическое ядро передней доли гипоталамуса (POAH) (397, 931), OVLT (397) и ME (530). Интрацеребровентрикулярное введение PGE2 выявляет мРНК c-fos у CRF-содержащих нейронов в пределах pPVN а также увеличение гяРНК CRF в pPVN (445). Действительно, рецепторы PG типа EP-1 (45), но не типа EP-3 (236, 826), были обнаружены в пределах PVN. Однако, основное внимание по определению потенциальных участков действия PG в пределах ЦНС, было сосредоточено на POAH. Простагландин E2 введенный в POAH стимулирует экспрессию Fos в pPVN (742) и секреция АКТГ, индуцированная введением PGE2 в POAH, может быть предотвращена антителами к CRF (931), указывая на важность активации гипоталамной секреции CRF. Однако, исследования производства CRF в гипоталамных эксплантатах in vitro, не подтвердили, что PGE2 влияет на секрецию CRF (57, 135, 652). Несмотря на факт, что внутривенное введение PGE2 увеличивает плазменные уровни АКТГ, прямой эффект PGE2 на секрецию АКТГ гипофизом in vitro, является подавляющим (921). Вместе, эти данные говорят, что действие PG на секрецию АКТГ in vivo проявляются на уровне гипоталамуса или других участках ЦНС.
Большинство исследований, изучающих эффект IL-1 или LPS на формирование PG, сосредоточилось на PGE2, уровни которого в крови крыс и кроликов увеличиваются при введении LPS (712, 935). Простагландин E2 может пересекать гематоэнцефалический барьер (183, 224), поднимая возможность, что PGE2 может проникать в мозг и стимулировать нейросекреторную активность pPVN. Однако, хотя начало увеличения уровней PGE2 в крови происходило одновременно с началом лихорадки после введения LPS или IL-1 у кроликов (712), у крыс, уровни PGE2 значительно не увеличивались, пока не был достигнут пиковый АКТГ ответ на IL-1beta (935). Кроме того, введение доз PGE2, которые производят уровни в крови в 100-400 раз больше, чем уровни после введения IL-1beta, имеют намного меньший эффект на плазменные уровни АКТГ, чем индуцированные IL-1beta непосредственно (935). Вместе, эти данные указывают, что увеличение проникновения PGE2 в мозг из большого круга кровообращения, вряд ли будет главным медиатором стимулирования секреторной активности HPA ось периферическим IL-1.
Кроме увеличения циркулирующих уровней PGE2, сам мозг является потенциальным источником PGE2 в ответ на периферическое введение IL-1 или LPS. Изоформы COX присутствуют в мозге нормальных крыс или мышей и преобладающе экспрессированы у нейронов (100, 104). Паттерн иммуноокрашивания для COX-1 и COX-2 различается и наиболее заметен в областях мозга, ответственных за обработку и интеграцию висцеральных и сенсорных сигналов и производство вегетативных, эндокринных и поведенческих ответов (100, 104, 400, 877). У крыс, концентрация PGE2 в OVLT, POAH, PVN, гиппокампе и ЦСЖ латерального желудочка, увеличавается в пределах 20 минут после внутривенного введения IL-1beta (429, 940). Все эти нейронные структуры демонстрируют иммунореактивность COX-1 и COX-2 (100, 104). Исследования ex vivo показали, что срезы гиппокампа мышей производят большее количество PGE2 после интраперитонеального или интрацеребровентрикулярного введения IL-1alpha или IL-1beta (950), принимая во внимание, исследования in vitro показали, что IL-1beta и IL-6 увеличивают производство PGE2, но не PGF2alpha, TxB2 или 6-keto-PGF1alpha гипоталамными эксплантатами крысы (582). Аналогично, периферическое введение LPS in vivo стимулирует гипоталамное производство PGE2 (789, 799), принимая во внимание, что IL-6 или острое местное воспаление увеличивают уровни PGE2 в ЦСЖ (169, 207). Клеточным источником PGE2 в ЦНС в ответ на LPS, местное воспаление, индуцированное скипидаром или IL-1, наиболее вероятно являются цереброваскулярные и/или связанные периваскулярные структуры, в которых мРНК COX-2 заметно индуцирована этими воздействиями (140-142, 231, 444, 903, 904) (см. секцию VD). (231) Микроглия, нейроны (140, 903), менингеальные макрофаги (231) и астроциты (652) могут быть другими возможными источниками PG в мозге.
Ингибиторы активности COX, такие как индометацин или ибупрофен, наиболее часто использовалист для исследования роли PG в ответе HPA оси на IL-1. Эти исследования также указали на важность метаболитов арахидоновой кислоты, но не указали на PG как на основной фактор. Периферическое введение индометацина аннулирует увеличение плазменной концентрации АКТГ после внутривенного введения IL-1alpha, IL-1beta или TNF-alpha (560, 569, 688, 694, 771, 880, 930). Наблюдаемое ингибирование не всегда является полным и продолжительным, даже когда индометацин или ибупрофен вводятся несколько раз (C. Rivier, неопубликованные данные). Индометацин производит подобное ингибирование индуцированной IL-1 секреции АКТГ, когда IL-1 вводится интрацеребровентрикулярно (399, 688, 930) или местно в ME (530), но результаты были противоречивы, когда IL-1beta вводился интраперитонеально (215, 685). В ответ на периферическое введение LPS или местное воспаление, ингибиторы COX уменьшают секрецию АКТГ. Этот эффект не может объяснен ингибирующим действием на воспаление per se (880, 884). Периферическое введение индометацина также ингибирует экспрессию Fos в pPVN у крыс после введения IL-1beta или LPS внутривенно, интраперитонеально или интрацеребровентрикулярно (443, 588, 718, 925) или у крыс при непрерывном введении IL-6 (589).
Поскольку индометацин или ибупрофен могут увеличивать базальную секрецию GC, предлагалось, что подавляющие эффекты ингибиторов COX на секрецию АКТГ, индуцированную цитокинами или воспалением, могут происходить из-за действия глюкокортикоидной обратной связи. Однако, множество данных указывает, что это вероятно не происходит. Например, увеличение плазменной концентрации АКТГ, произведенное или IL-1beta (694) или TNF-alpha (771) у адреналэктомизированных крыс, также аннулируется индометацином, принимая во внимание, что увеличение секреции АКТГ в ответ на другие разнообразные стимулы, включая внутривенный CRF (771, 880), электрошок (880), иммобилизацию (399) или индуцированную инсулином гипогликемию (771), не затрагивается ингибироторами COX. В исследованиях in vitro также было продемонстрировано, что производство CRF гипоталамными эксплантатами в ответ на IL-1alpha, IL-1beta или IL-6, предотвращается индометацином (56, 135, 500, 583). Наконец, иммунонейтрализация с помощью интрацеребровентрикулярного введения антител к PGE1, PGE2 или PGF2alpha, также производит существенное уменьшение индуцированного IL-1 увеличения плазменных уровней АКТГ (937). Вместе, эти данные являются доводами в пользу прямой роли PG как медиатора индуцированной IL-1 активации HPA оси.
Хотя общепринято, что генерация PG в ответ на IL-1 и множество других цитокинов (например, TNF-alpha, IL-6), является важным шагом в их стимулирующем действии на секреторную активность HPA оси, анатомические участки и типы клеток, ответственные за синтез PG, менее ясны. Возможные участки обсуждаются в секциях VD и VE.
2. Окись азота
Окись азота является предполагаемым нейромодулятором в ЦНС млекопитающих (107, 186, 555). Локализация NO синтазы (NOS), фермента, ответственного за формирование NO в пределах гипоталамуса (885), позволила предложить роль NO как медиатора действия цитокинов (284, 509, 948) и выдвинуть гипотезу, что NO может играть роль в регулировании HPA оси цитокинами, способом сходным или дополняющим действие PG. Однако, при активации HPA оси IL-1 или другими воспалительными стимулами, первичный эффект NO на ответ HPA оси ограничен (172, 458, 687, 692, 884, 885, 887, 993). Следующие параграфы описывают распределение и регулирование NOS в пределах HPA оси а также эксперименты, исследующие влияние NO на ответ HPA оси на IL-1.
NOS - фермент, который катализирует трансформацию L-аргинина в L-цитруллин и газообразные медиаторы NO. Были идентифицированы несколько изоформ NOS (265). NOS I экспрессирована в центральной и периферической нервной системе и также известна как нейронная NOS. NOS II была найдена у многих типов клеток, гепатоцитов, макрофагов, клеток гладких мышцы и глии. Наконец, NOS III является синонимом эндотелиальной NOS. Эти три изоформы кодируются различными генами, отличаются способом и паттерном экспрессии (NOS I и III экспрессированы конституитивно, принимая во внимание, что NOS II присутствует только после индукции цитокинами или эндотоксинами), зависимой (NOS I и III) или не зависимой (NOS II) от кальция / кальмодулина и имеют различные кинетические свойства. Действия NOS как нейромодулятора было признано после обнаружения, что ингибиторы NOS блокируют увеличение синтеза cGMP в срезах мозга, индуцированное глютаматом, действующим на рецепторы NMDA (276). Однако, NOS не ведет себя подобно обычному нейромедиатору, так как не влияет на целевые клетки посредством взаимодействия с поверхностым рецептором. Скорее, NOS формирует ковалентные связи с несколькими потенциальными постсинаптическими внутриклеточными целями (например, гуанилилциклазой).
Иммунореактивность NOS и мРНК NOS присутствуют в пределах PVN и SON гипоталамуса (19, 107, 127, 129, 147, 456, 917-919). В pPVN, NOS была найдена в пределах субпопуляции нейронов, экспрессирующих CRF (782, 870). Обстоятельства, способные изменять активность pPVN, например, стресс иммобилизации (129), интрацеребровентрикулярное введение CRF (459), интрацеребровентрикулярное введение IL-1beta (459) или LPS (456), увеличивают экспрессию NOS в pPVN, предполагая роль NOS в регулировании HPA оси. Кроме того, подобно членам семейства IL-1, мРНК NOS экспрессирована у цереброваскулярных элементов (969, 974). NOS была найдена и в задней (106, 107) и в передней (148) доле гипофиза. В передней доле гипофизе, NOS и мРНК NOS у нормальных животных были слабо экспрессированы, но индуцировались системным LPS (974). NOS также была обнаружена портальной системе гипофиза (149).
Возможная роль NO в биологических процессах была определена с помощью доноров NO (L-аргинин, нитропруссид), ингибиторов активности NOS (производные аргинина) и скавенджеров NO (гемоглобин). Ингибиторы активности NO имеют низкую молекулярную массу (150-500 Da) и гематоэнцефалический барьер не препятствует их распространению.
Внутривенное введение крысам субстрата NO, L-аргинина, уменьшает увеличение плазменных уровней АКТГ в ответ на внутривенное введение IL-1beta (692). Наоборот, внутривенное введение ингибитора NOS NG-нитро-L-агринин метил эстеразы (L-NAME), усиливает и продлевает секрецию АКТГ и кортикостерона в ответ на IL-1beta. Это действие, которое является специфическим для L-изомера NAME (активного для NOS), может быть полностью изменено введением L-аргинина и не связано с его гипертензивными эффектами (687, 692, 885, 887). Таким образом эндогенный NO, ингибирует АКТГ ответ на системный IL-1beta. Усиление АКТГ секреции L-NAME также наблюдается при ответе на индуцированное скипидаром местное воспаление и системный LPS, но не на IL-1beta, введенный непосредственно в мозг (интрацеребровентрикулярно) (692, 884).
Механизмы, посредством которых NO влияет на ответ HPA оси на IL-1beta, воспаление и эндотоксины, пока не ясны, но полученные данные проливают некоторый свет на вероятные кандидаты. Поскольку CRF - обязательный медиатор АКТГ ответа на IL-1, множество исследований in vitro изучало влияние NO на секрецию CRF/AVP гипоталамусом. Однако, в гипоталамных эксплантатах, ингибиторы NO ослабляли (116, 724) или усиливали (172, 993) секрецию CRF/AVP, индуцированную IL-1. L-NAME in vivo заметно не влиял на секрецию АКТГ, индуцированную CRF, но усиливал АКТГ ответ на AVP и окситоцин (692). Последние результаты указывают на возможность, что увеличение чувствительности кортикотрофов к AVP и/или окситоцину после введения L-NAME может объяснить усиление секреции АКТГ, индуцированное IL-1beta. Однако, антитела к AVP не влияют на усиление индуцированной IL-1beta секреции АКТГ, произведенной L-NAME (687). Недавнее исследование селективных ингибиторов NOS (887), идентифицировало эндотелиальную NOS (тип III), как наиболее вероятный источник NO, которая ингибирует ответ HPA ответ на IL-1beta, указывая на возможность функциональных взаимодействий между NO и IL-1 (см. секцию VD). С другой стороны, комбинация адренергических антагонистов, пропанолола и празозина, полностью изменяет эффект L-NAME на индуцированную IL-1, но не AVP секрецию АКТГ (687), предполагая, что подавляющее действие NO на активность HPA оси может происходить из-за подавляющего эффекта на катехоламинергические пути (см. секцию VF).
Интересно отметить, что подавляющий эффект NO на ответ HPA оси на IL-1 имеет провоспалительные последствия из-за уменьшения эндогенных уровней GC. Это провоспалительное нейроэндокринное действие NO согласуется с его местным действием, как медиатора воспаления на участке повреждения ткани или инфекции (449). Поэтому, NO, возможно, является новым классом медиаторов, которые вместе с большими семействами цитокинов, нейромедиаторов и гормонов, составляют обычный химический язык иммунной и нейроэндокринной системы.
D. Индукция посредников на внутренней поверхности гематоэнцефалического барьера
Хотя имело место множество дебатов относительно точного местоположения рецепторов IL-1 в пределах нейронных элементов мозга (см. секцию IVA1A), все исследования находятся в согласии, что цереброваскулярные и периваскулярные элементы - наиболее заметный локус экспрессии мРНК IL-1R1 в мозге крыс или мышей (178, 238, 969, 970, 972, 982). Интенсивный сигнал для мРНК IL-1R1 был описан у эндотелиальных клеток посткапиллярных венул во всем мозге (178, 238, 972, 982) и множество данных поддерживают роль эндотелиальных рецепторов IL-1 в передаче сигналов из крови в мозг. Иммунореактивность IL-1beta была найдена у эндотелиальных клеток, выстилающих мозговые венулы у крыс после периферического введения LPS (901), принимая во внимание, что увеличение иммуноокрашивания PGE2 было обнаружено в мозговом микроциркуляторном русле после периферического введения IL-1beta (904) или LPS (903). Действительно, периваскулярные элементы (вероятно микроглия) - главный участок индукции мРНК COX-2 после ввведения LPS, скипидара или IL-1 (103, 140-142, 231, 444). Периваскулярные клетки были идентифицированы как первичная группа клеток в пределах ЦНС, которые экспрессируют IL-1R1 или IL-1beta, индуцированные cIEG через 1 час после внутривенного введения IL-1beta (238). Наконец, экспрессия IL-1R1 наблюдалась у периваскулярных клеток, но не у нейронных элементов после внутривенного введения IL-1beta (238).
Исследования показали, что клетки церебрального эндотелия экспрессируют лиганды цитокинов (например, IL-1alpha, IL-1beta, IL-6), ферменты (ICE) или рецепторы (например, TNF, IL-1) и являются участками действия цитокинов (49, 51, 171, 190, 242, 380, 713, 970). Индукция посредников, таких как NO (412, 969) или PG (77, 78, 201, 904), является возможным механизмом, посредством которого цитокины могут влиять на функцию мозга.
Было проведно множество исследований in vitro, чтобы изучить формирование PG в сосудах мозга. Воздействие LPS на изолированные микрососуды мозга (главным образом капилляры), увеличивало секрецию PGE2, но не 6-keto-PGF1alpha (77, 78). Исследования Van Dam с коллегами (904) показало, что культура эндотелиальных клеток мозга крысы (RCEC) специфически связывают крысиный IL-1beta и экспрессируют мРНК IL-1R1, но не IL-1R2. Простагландин E2 - основной метаболит арахидоновой кислоты, обнаруженный у эндотелиальных клеток в мозге крысы (201) и IL-1beta увеличивает секрецию этими клетками PGE2 и 6-keto-PGF1alpha, но не TxB2, после 3 часов инкубации. Как и IL-1beta, IL-6 стимулирует секрецию PGE2 и 6-keto-PGF1alpha в течение 3 часов (201).
Индукция секреции PGE2 эндотелиальными клетками в ответ на IL-1 (или другие цитокины) является вероятным механизмом, посредством которого IL-1 мог бы влиять на гипоталамус. Формирование простагландина ндотелиальными / периваскулярными клетками, экспрессирующих рецепторы IL-1 в пределах PVN (178, 982), может быть прямым механизмом активации HPA оси в ответ на переносимый кровью IL-1. Однако, другие свидетельства также указывают, что CVO и/или катехоламинергические группы клеток - важные анатомические структуры, которые являются медиаторами эффета IL-1 на HPA ось и имеется значительное количество свидетельств, что формирование PG (возможно периваскулярными элементами) происходит в этих областях в ответ на IL-1.
E. Действия в циркумвентрикулярных органах (CVO)
То, что некоторые области ЦНС лишены гематоэнцефалического барьера, позволяет цитокинам взаимодействовать с нейронными элементами. Эти регионы включают структуры, граничащие с третьим желудочком (AV3V) (OVLT и SFO), ME, AP, заднюю долю гипофиза, субкомиссуральный орган и шишковидную железу. Их капилляры не формируют соединительные комплексы (305). Циркумвентрикулярные органы содержат капилляры с большей проницаемостью, чем остальная часть ЦНС и плотность капилляров в этих областях является необычайно высокой (369). Проникновение цитокинов в мозговую паренхиму через CVO не подразумевает, что они могут распространяться и взаимодействовать с более глубокими структурами мозга, однако, так как переходы между измененными эпендимоцитами в этих областях формируют барьер между CVO и остальной частью мозга (369). Но эти ''негерметичные'' участки являются причиной, по которой цитокины, например IL-1, могут влиять на нейронную активность в этих областях ЦНС. CVO, которые были предложены в качестве потенциальных участков действия IL-1 - структуры, граничащие с AV3V регионом (в особенности OVLT), МЕ и самое заднее поле (area postrema).
1. Структуры, граничащие с антеровентральной границей третьего желудочка
Накоплено значительное количество данных, что OVLT может служить границей раздела между кровью и мозгом при воспалительном ответе (568, 821). В частности, известна роль OVLT при лихорадке, индуцированной различными цитокинами или воспалительными стимулами и OVLT был предложен как возможный ''путь'' влияния IL-1 на нейронную активность (86, 568, 820, 822).
Эфферентное проецирование OVLT и SFO к PVN являются свидетельством, указывающим на влияние этих структур на активность нейросекреторных нейронов (369, 474, 783). Множество анатомических исследований пытались выяснить, может ли регион AV3V быть участком, отзывчивым к системному IL-1beta. Индукция мРНК c-fos в OVLT и SFO была отмечена в пределах 30-60 минут после интраперитонеального введения IL-1beta (98, 187) и экспрессия белка Fos была очевидной через 3 часа после внутривенного введения IL-1beta (237). Аналогично, мРНК c-fos была обнаружена в OVLT и SFO после внутривенного введения IL-6 (899) и после периферического введения LPS (232, 679, 718). SFO - одна из областей мозга крысы, которая демонстрирует изменения белкового синтеза в пределах 1 часа после подкожного введения IL-1beta (962), принимая во внимание, что нейроны AV3V демонстрируют ответ на IL-1beta в пределах 15 минут после внутриартериального введения IL-1beta (610). Эксперименты с введением кроликам IL-1beta, меченного коллоидным золотом (внутривенно), продемонстрировали, что в пределах 10 минут после внутривенного введения, IL-1beta связан с белками просвета на поверхности эндотелия в OVLT (330). Это сопровождается транспортом IL-1beta к базальной мембране, хотя IL-1beta не был обнаружен в POAH (330). Будучи отзывчивым к IL-1beta, регион AV3V был участком производства IL-1beta в ответ на системное введение LPS (см. секцию IVA2B).
С участием AV3V в качестве медиатора действия системного IL-1beta на HPA ось, совместимо заметное уменьшение секреции АКТГ в ответ на внутривенный IL-1beta, но не на стресс иммобилизации, при повреждении OVLT радиочастотным излучением или каинитовой кислотой (397). Однако, данных о существовании рецепторов IL-1 у нейронных элементов в пределах AV3V, нет. Ввиду большой плотности сосудистой сети в этом регионе и существовании рецепторов IL-1 на эндотелиальных и периваскулярных клетках, они могут являтьтся клеточными целями для IL-1beta в пределах AV3V. Увеличение производства PGE2 в этом регионе после системного введения IL-1beta или LPS (429, 903, 940), совместимо с идеей формирования PG, как основного действия IL-1beta в AV3V. Кроме того, микровведение индометацина в OVLT заметно уменьшает увеличение плазменой концентрации АКТГ в ответ на IL-1beta (397). То, что смежные нейроанатомические структуры, такие как POAH, являются целью для PG, поддержано множеством наблюдений. POAH (но не OVLT) имеет более высокую плотность участков сцепления PGE2 (523, 524, 933, 934), мРНК рецептора PG EP-3 (236, 826) и плазменный АКТГ ответ на внутривенный IL-1beta ингибируется повреждением POAH (электролитически или каинитовой кислотой) или микровведением антагониста PG в этот регион мозга (397).
Хотя имееются свидетельства, что AV3V, и в особенности OVLT, может быть нейроанатомическим участком действия циркулирующего IL-1beta, ни один из экспериментов, в которых изучалась эффекты хирургической или фармакологической манипуляции с OVLT, не показал полное ингибирования плазменного АКТГ ответа на IL-1beta (397). Кроме того, доза IL-1beta, используемая в этих исследованиях была чрезвычайно высокой (10 µg/kg внутривенно). В более современных исследованиях, минимальная доза IL-1beta, необходимая для индукции белка Fos в OVLT (3.58 µg/kg) была примерно в 10 раз выше, чем необходимая для индуцирования экспрессии белка Fos в pPVN (237). Это позволяет предположить, что участие OVLT в ответе HPA оси на системный IL-1beta может быть ограничена высокими циркулирующими уровням IL-1beta.
2. Срединное возвышение (ME)
Будучи областью гипоталамуса, которая имеет развитую сосудистую сеть, частично лишенную гематоэнцефалического барьера, ME - потенциальный участок, где циркулирующие факторы могут увеличивать секрецию CRF, взаимодействуя с нервными окончаниями pPVN и стимулируя секрецию CRF без непосредственного стимулирования клеток pPVN. Свидетельства, поддерживающие концепцию, что ME является первичным участком действия циркулирующего IL-1 при возбуждении секреции CRF, были получены в множестве экспериментов. Например, микровведение IL-1alpha, IL-1beta или IL-6 в ME быстро стимулирует секрецию АКТГ (525-527, 530, 772). Дозы IL-1 или IL-6, необходимые чтобы выявить увеличение плазменой концентрации АКТГ после микровведения в ME, значительно (в 2-5 раз), меньше чем необходимые, чтобы выявить увеличение уровней АКТГ после внутривенного введения цитокинов. Плазменный АКТГ ответ на введение IL-1beta в ME заметно уменьшается индометацином (530), предполагая важность формирования PG как промежуточного шага. Однако, исследования in vitro, которые пытались определить, увеличивается ли производство CRF при инкубации гипоталамных эксплантатов (которые включают ME) с различными цитокинами и может ли это увеличениее быть объяснено действием цитокинов на ME, получили противоречивые результаты (583, 813, 863).
Хотя внутривенный IL-1beta стимулирует мРНК c-fos и белка Fos в PVN через 60-180 минут, наблюдение, что интрацеребровентрикулярное и внутривенное введение IL-1beta производит различную экспрессию мРНК c-fos в PVN через 30 минуты, позволили предположить, что ME может быть первичной целью IL-1beta после внутривенного введения (684). Это заключение было основано на факте, что хотя оба способа введения IL-1beta быстро стимулируют секрецию АКТГ, все же мРНК c-fos в pPVN через 30 минут наблюдалась только после интрацеребровентрикулярного введения IL-1beta. Это предлагает, что pPVN является ранней целью для IL-1beta после интрацеребровентрикулярного, но не внутривенного введения. Поскольку оба способа введения IL-1beta выявляют быстрое (в пределах нескольких минут) увеличение секреции CRF, казалось вероятным, что IL-1beta, введенный внутривенно, действует на уровне ME (684). Однако, нейроанатомических данных, поддерживающих эту гипотезу, мало. Гистохимические исследования описали экспрессию мРНК IL-1R1 у крыс в ME, как слабую (982) или отсутствующую (238, 972), принимая во внимание, что у мышей, экспрессия наблюдалась лишь у отдельных клеток (178). Меченые радиоизотопами лиганды, показали или слабые (251) или никаких (516) сигналов в ME у крыс и никаких специфических сигналов в ME у мышей (30, 848). Действительно, хотя LPS стимулирует мРНК c-fos в нескольких слоях ME (679), индукция мРНК c-fos или белка Fos не наблюдается в ME в ответ на системное введение IL-1beta (98, 187, 237, 588).
3. Самое заднее поле (area postrema - AP)
Недавние исследования продемонстрировали участие AP в активации HPA в ответ на внутривенное введение IL-1beta (238). Принимая во внимание, что другие циркумвентрикулярные органы не содержат рецепторы IL-1 (по крайней мере в нейронных элементах), AP демонстрировало положительный сигнал гибридизации для мРНК IL-1R1, хотя тип клеток, экспрессирующих IL-1R1 не был идентифицирован. Наиболее важно, что AP - единственный циркумвентрикулярный орган, который демонстрирует экспрессию cIEG в ответ на внутривенное введение IL-1beta (237, 238). Однако, удаление AP не влияет на индукцию мРНК CRF или экспрессию Fos в пределах PVN в ответ на IL-1beta (235), предполагая, что AP не критически важный регион для активации PVN в ответ на IL-1beta.
F. Потенциальная роль катехоламинов и свидетельства активации медуллярных групп клеток
Кроме PG, имеется второй класс посредников, которые являются медиаторами индуцированной IL-1 активации HPA оси, а именно, моноамины. Содержание моноаминов в гипоталамусе и других областях ЦНС изменяется в ответ на иммунологические вызовы, например, эритроциты овцы (69, 767, 997), NDV (220, 221), Poly I:C (221), вирус гриппа (219) и периферическое введение LPS (193, 212, 222, 450, 478). Интраперитонеальное введение IL-1alpha или IL-1beta мышам, также увеличивает метаболизм норадреналина (NE) и серотонина, наиболее существенно в гипоталамусе (211, 222). Аналогично, внутривенное или интраперитонеальное введение IL-1beta увеличивает оборот NE в гипоталамусе (включая PVN) а также в других регионах мозга крысы (386, 553, 790). Интрагипоталамная или интрацеребровентрикулярная инфузия IL-1beta также модулирует уровни моноаминов в гипоталамусе (554, 773, 776, 860). Интраперитонеальное введение IL-2 увеличивает оборот NE в гипоталамусе у мышей (996). Периферическое введение IL-6 производит небольшое (222) или никакого увеличения (213, 858, 996) оборота NE и серотонина. Интраперитонеальное введение TNF-alpha не имело никакого эффекта на гипоталамный оборот NE у мышей (213) или крыс (858), но ингибировало секрецию NE изолированным ME in vitro (226).
Имеется большое число свидетельств, что норадренергическая иннервация гипоталамуса влияет на секрецию CRF (9, 649, 727, 739, 833). PVN и SON являются двумя наиболее значительными терминальными полями катехоламинергических нейронов. Повреждение путей передачи сигналов от катехоламинергических групп клеток до PVN, нарушало ответ HPA оси на разнообразные стимулы (181, 832).
Использование антагонистов адренергических рецепторов для исследования роли катехоламинов в индуцированной IL-1 активации HPA оси, дало противоречивые данные (134, 695, 949). Повреждение катехоламинергических волокон (используя нейротоксичность 6-гидроксидофамина), производит существенное уменьшение гипоталамной концентрации NE и ингибирует увеличение плазменной концентрации АКТГ или кортикостерона на интрацеребровентрикулярное или интраперитонеальное введение IL-1beta (160, 949). Подобный ингибирующий эффект был отмечен, когда 6-гидроксидофамин вводился в латеральный желудочек (526, 949) или непосредственно в PVN (160). Дискретное повреждение катехоламинергических волокон, входящих в гипоталамус (воздействуя на дорсальные, вентральные или промежуточные аксоны) показало, что увеличение плазменных уровней АКТГ в ответ на внутриартериальное введение IL-1beta или LPS, или введение IL-1beta непосредственно в PVN, зависят от места введения цитокина и точного местоположения повреждения (39, 291).
Недавние исследования позволили получить свидетельства важной роли катехоламинергической иннервации гипоталамуса в активации HPA оси в ответ на системный IL-1. Введение IL-1beta, внутривенно или интраперитонеально, приводит к существенной экспрессии мРНК c-fos или белка Fos в NTS крыс (98, 187, 237). Все исследования распределения мРНК c-fos или белка Fos в ЦНС в ответ на системное введение LPS, отметили индукцию экспрессии немедленно-ранних генов (вероятно у катехоламинергических групп клеток) в пределах 1-3 часов после введения LPS (230, 232, 678, 679, 718, 924). Ericsson с коллегами (237) описали экспрессию белка Fos в среднем и комиссуральном ядре солитарного тракта (NTS) а также в ростральной вентролатеральной мозговой оболочке и в дорсальном моторном ядре блуждающего нерва в пределах 3 часов после внутривенного введения IL-1beta. Эти авторы продемонстрировали, что экспрессияв Fos в NTS чувствительна к IL-1beta и индуцируется при дозах более низких, чем необходимые для выявления специфических сигнал в пределах pPVN.
Маловероятно, что активация катехоламинергических групп клеток происходит из-за прямого действия IL-1, так как эти группы клеток не экспрессируют мРНК IL-1R1 (238). Учитывая важную роль PG в ответе HPA оси на IL-1 (см. секцию VC1 и VD), не удивительно, что имеется возможность, что PG - важный медиатор между действием IL-1 и активацией катехоламинергических нейронов. Было показано, что индукция белка Fos (235) и изменения гипоталамного оборота моноаминов (534, 857, 858, 860), произведенные IL-1, может быть предотвращена ингибиторами COX. Действительно, рецепторы PG типа EP-3, присутствуют в NTS и вентролатеральной мозговой оболочке, в которой были обнаружены чувствительные к IL-1 катехоламинергические нейроны (236). Кроме того, введение PGE2 в вентролатеральную мозговую оболочку, вызывает паттерн экспрессии Fos в pPVN, походящий на произведенный внутривенным введением IL-1beta (235). Эти наблюдения позволили предположить, что PGE2, произведенный периваскулярными клетами мозговой оболочки в ответ на IL-1, активизирует местные катехоламинергические нейроны, которые проецируются на PVN (235).
Кроме роли в активации HPA оси, произведенную взаимодействием IL-1 с нейронными и/или цереброваскулярными элементами в пределах мозга, недавно стала очевидна важность катехоламинергических групп клеток как медиаторов влияния периферического IL-1 на мозг. Медуллярные группы клеток играют важную роль в обработке висцеральной и сенсорной информации, которую передают сенсорные компоненты блуждающего и языкоглоточных нерва (739). Свидетельства, что неповрежденный блуждающий нерв является важным для ответа ЦНС на воспаление в брюшной полости (см. секцию VG) говорит, что мозг может получать информацию относительно локальной периферичекой активности IL-1 (238).
G. Активация афферентных волокон блуждающего нерва
Исследования последних нескольких лет указали на новый маршрут, посредством которого периферические цитокины могут влиять на ЦНС без проникновения в мозговую паренхиму, внутреннюю поверхность гематоэнцефалического барьера или даже большой круг кровообращения. В 1994 г. Nance с коллегами (925) продемонстрировали, что индукция белка Fos в PVN и SON в гипоталамусе, произведенная интраперитонеальным введением LPS, предотвращается хирургическим субдиафрагмальным рассечением блуждающего нерва (SDVX) за несколько дней до введения LPS (925). В это же время, Dantzer и коллегами (90) показали, что SDVX уменьшает нарушения поведения после интраперитонеального введения LPS, принимая во внимание, что Watkins с коллегами (944) сообщили, что гипералгезия, произведенная интраперитонеальным введением LPS, также уменьшилась предшествующим рассечением блуждающего нерва (944). Эти данные предлолагали, что блуждающий нерв является афферентным маршрутом, посредством которого воспаление в пределах брюшной полости может влиять на мозг. Множество независимых лабораторий подтвердили существование такого механизма у крыс, мышей и морских свинок. SDVX уменьшает лихорадку (297, 389, 607, 701, 761), нарушения сна (389, 607), оборот NE (359), нарушения пищевого поведения (90, 108, 451) и увеличение уровней мРНК IL-1beta в гипоталамусе (451) индуцированные введением LPS в брюшную полость.
Dantzer с коллегами (90, 451) продемонстрировали, что ингибирующий эффект SDVX на интраперитонеальное введение LPS не происходит из-за уменьшения периферического воспалительного ответа, так как эта операция не влияла на индуцированную LPS экспрессию цитокинов в тканях, иных чем мозг (90, 451). Это говорит, что SDVX нарушает передачу сигналов цитокинов к мозгу. Действительно, недавно было показано, что лихорадка (607, 942), сон (319), циркуляция NE (261), гипералгезия (945), нарушения поведения (88, 89, 294) и индукция мРНК IL-1beta в ЦНС (320) произведенные интраперитонеальным введенеим IL-1, уменьшены или отсутствувуют у животных после проведения SDVX. Аналогично, SDVX ингибирует гипералгезию и отвращение к пище, индуцированное интраперитонеальным введеним TNF-alpha (294, 941). Хотя SDVX ингибирует эффекты интраперитонеального введения TNF-alpha (например, гипералгезию, активацию HPA оси), '' периферические'' эффекты (например, уменьшение уровней глюкокортикоидсвязывающего глобулина) не затрагиваются этой хирургической процедурой (262), предполагая что роль блуждающего нерва является специфической для остро-фазового ответа со стороны ЦНС.
Блуждающий нерв также играет роль в активации HPA оси в ответ на периферическое введение LPS или цитокинов. У крыс, SDVX уменьшает увеличение плазменной концентрации АКТГ и кортикостерона в ответ на интраперитонеальное введение IL-1beta (261, 390). Аналогично, число CRF-содержащих нейронов в pPVN, которые уверенно окрашиваются для Fos и степень увеличения плазменной концентрации АКТГ, произведенные LPS, уменьшены у животных после проведения SDVX (279), указывая, что ваготомия влияет на сигналы активации, поступающие к гипоталамусу. SDVX также блокирует увеличение плазменных урорвней кортикостерона, индуцированных интраперитонеальным введением TNF-alpha (262).
Множество исследований пытались выяснить, каким образом SDVX влияет на остро-фазовые ответы индуцированные LPS или IL-1. SDVX - серьезная хирургическая операция, приводящая к тому, что животные после SDVX являются менее ''здоровыми'', чем крысы, у которых была проведена плацебо-операция (аналогичная по объему, но без ваготомии) или крысы группы контроля. Предлагалось, что неспособность крыс, у которых была проведена SDVX (SDVX-крысы) отвечать на воспалительные стимулы, может быть связана с уменьшением их статуса здоровья, скорее чем со специфическим эффектом SDVX на связь иммунной системы с мозгом. Однако, у SDVX-крыс, получавших специальную предоперационную подготовку, ответ на интраперитонеальное введение LPS в виде лихорадки, был нарушен (699). Кроме того, SDVX-крысы имеют ответ в виде повышения температуры тела (543, 700), гипералгезии (941) и активации HPA оси (390, 943) в ответ на невоспалительные стимулы (например, инсулин или электрошок), подобный крысам, у которых была проведена плацебо-операция.
Хотя важность афферентных волокон блуждающего нерва в остро-фазовом ответе на абдоминальное воспаление не бесспорна (755), число свидетельств, поддерживающих эту гипотезу, значительно и множество исследователей пытались понять, как цитокины могут взаимодействовать с блуждающим нервом. Введение IL-1 в печеночную вену производит увеличение электрической активности печеночного ответвления блуждающего нерва (586, 587). Однако, в отличие от SDVX, рассечение печеночного ответвления блуждающего нерва не ингибирует увеличения плазменной концентрации кортикостерона или гипоталамного NE в ответ на интраперитонеальное введение IL-1 (261) или подавление аппетита в ответ на LPS (447). Гипотеза, что C-волокна являются основным типом волокна, передающим сигналы к мозгу, также была опровергнута (109). В настоящее время известно, что хотя абдоминальные афферентные волокна блуждающего нерва не содержат функциональные рецепторы к IL-1, абдоминальные параганглии, специфически связывают биотинилированные IL-1ra (296). Кроме того, макрофаги обнаруженные вблизи афферентных волокон и параганглий после введения LPS (295), предлагают связь между клетками, продуцирующимим IL-1, рецепторами IL-1 и блуждающим нервом.
Блуждающий нерв, возможно, является важным специфическим звеном при передаче сигналов к мозгу при интраабдоминальном воспалении. Это подтверждается отсутсвием эффекта SDVX на остро-фазовые ответы (235, 399), когда или IL-1 или LPS вводятся не в брюшную полость (88, 89, 235, 297, 399, 645). Однако, деградация C-волокон при продолжительном системном введении капсаицина, ингибирует увеличение плазменных уровней АКТГ на внутривенное введение IL-1beta у взрослых крыс (932). Кроме того, начальное (в пределах 45 минут) увеличение плазменной концентрации АКТГ, произведенное внутримышечным введением скипидара, уменьшается новорожденных крыс, при введении капсаицина (879). Поэтому, нельзя исключть, что другие нервные волокна (например, кожи или мышц), способны к передаче сигналов в мозг при возникновении высокой местной концентрации цитокинов.
H. Синтез цитокинов в пределах мозга
Предыдущее обсуждение было сфокусирорвано на ответе на вопрос, как IL-1, произведенный на периферии, может действовать на мозг и производить активацию HPA оси. Недавние исследования продемонстрировали, что IL-1, как и другие цитокины, также производится в мозге (см. секцию IVA2), что поднимает вопрос, может ли IL-1, произведенный в мозге, влиять на секреторную активность HPA оси. Существующие данные относительно распределения рецепторов IL-1 в пределах мозга, казалось бы, являются доводом против роли IL-1 в регулировании активности гипоталамуса, так как рецепторы IL-1 преобладающе расположены в барьерных регионах (например, периваскулярных элементах), подходящих для передачи сигнала IL-1 от крови к мозгу, но не для действия IL-1, произведенного в пределах мозга. Единственное ядро гипоталамуса, которое экспрессирует рецепторы IL-1 на нейронных элементах - дугообразное ядро, которое, как известно, влияет на секреторную активность HPA оси (238), но чья роль пока не была определена. Несмотря на отсутствие свидетельств действия мозгового IL-1 на секреторную активность HPA оси, основанных на распределении рецепторов IL-1 в мозговой паренхиме, IL-1, введенный непосредственно в мозг стимулирует экспрессию Fos в pPVN, увеличивает уровни мРНК CRF в PVN, увеличивает секрецию CRF МЕ и увеличивает плазменные уровни АКТГ и кортикостерона (см. секцию IVA3). Кроме того, дозы IL-1, необходимые для стимулирования секреторной активности HPA оси, при введении непосредственно в мозг, более низкие, чем когда цитокин вводится на периферии, ясно указывая на ЦНС как на участок действия IL-1. Наконец, инкубация гипоталамуса с IL-1 in vitro выявляет секрецию CRF (см. секцию IVA3). Вместе, эти данные настоятельно указывают, что когда производство IL-1 в ЦНС увеличено, это, вероятно, стимулирует секреторную активность HPA оси.
Различные патологии, включающие инфекцию, травму и ишемию ЦНС, явно стимулируют синтез IL-1 и других цитокинов в пределах мозга. Однако, лишь немногие исследования изучили регулирование HPA оси цитокинами при таких патологиях, хотя было выполнено исследование роли произведенного в пределах мозга IL-1 в активации HPA оси в ответ на вирусную болезнь ЦНС. Например, интрацеребральная инфузия или трансгенная экспрессия gp120, белка ядерной оболочки вируса иммунодефицита человека, увеличивает биологическую активность и уровни мРНК IL-1 а также увеличивает плазменные концентрации АКТГ и кортикостерона (112, 355, 657, 661, 827). Дополнительная инфузия альфа-меланоцит-стимулирующего гормона (который ингибирует действие, но не синтез IL-1), полностью предотвращает увеличение плазменной концентрации кортикостерона, предполагая что IL-1 производится в мозге как следствие инфузии gp120 и производит активацию HPA оси (827). Аналогично, была предположена индукция IL-1beta в пределах мозга в качестве механизма, ответственного за активацию HPA оси у крыс после вакцинации нейротропным вирусом простого герпеса-1 (50).
Многие исследования пытались ответить на намного более широкий вопрос, имеющий важное значение для концепции нейроиммунного регулирования, то есть, могут ли события, прямо не связанные с повреждением ЦНС, стимулировать в пределах мозга синтез цитокинов, которые впоследствии регулируют активность ЦНС и играют физиологическую роль в организации адаптивного ответа. В частности, исследователи сосредоточилась на возможности, что иммунный / воспалительный ответ на периферии происходит параллельно или даже инициирует производство цитокинов в пределах ЦНС. Как детально рассмотрено в секции IVA2B, периферическое введение LPS стимулирует синтез цитокинов и, в частности, IL-1 в пределах мозга. Однако, большое число исследований клеточной локализации цитокинов показали, что IL-1 и мРНК IL-1 в пределах мозговой паренхимы индуцируются в дозах значительно больших (от сотен микрограмм до единиц миллиграмм), чем необходимо для производства физиологических ответов, таких как активация HPA оси (< 1 µg/kg). Кроме того, индукция цитокинов в пределах мозговой паренхимы наблюдается только через несколько часов после введения LPS (при том, что увеличение секреции АКТГ начинается через 30-45 минут). Дополнительно, локализация мРНК IL-1 и IL-1 в барьерных областях, таких как CVO и периваскулярных регионах, предполагает участок действия цитокинов до гематоэнцефалического барьера, на стороне крови. Поэтому, синтез цитокинов в пределах мозговой паренхимы, казалось бы, не является абсолютным требованием для по крайней мере для тех ответов, которые происходят немедленно после введения LPS.
Однако, некоторые исследования продемонстрировали, что ингибирование действия IL-1 в пределах мозга после интрацеребрального введения антител к IL-1beta может ингибировать остро-фазовые ответы на периферическое введение LPS (418, 709). Однако, эти эксперименты не смогли продемонстрировать, что нейтрализованный IL-1beta был произведен в пределах мозга, а не поступал в мозг с периферии (см. секцию VB) а также указали, что участок действия введенных антител не обязательно находится в пределах мозга. Недавно мы обнаружили, что предварительное интрацеребровентрикулярное введение антител к TNF-alpha крысам, задерживает начало увеличения плазменной концентрации АКТГ в ответ на внутривенное введение 5 µg/kg LPS, предполагая действие TNF-alpha в пределах мозга (889). Однако, внутривенное введение тех же самых антител, производило качественно и количественно идентичный эффект (889). Последующие исследования также показали, что антитела на периферии после интрацеребровентрикулярного введения бысто разрушаются и концентрации на периферии, достаточные для иммунонейтрализации существуют очень короткий период времени (~1-4 часа) (890). Эксперименты, использующие введения антител или антагонистов рецепторов, чтобы ингибирорвать действие цитокинов в пределах мозга, должны ясно продемонстрировать, что наблюдаемые эффекты не могут быть объяснены действием ингибиторов на периферии, особенно при при высоких концентрациях цитокинов в крови и периферических тканях при воспалении или инфекции.
Kakucska с коллегами (387) продемонстрировали, что непрерывная интрацеребровентрикулярная инфузия человеческого IL-1ra полностью предотвращает увеличение мРНК CRF в pPVN наблюдаемое через 8 часов после введения LPS (2.5 милиграмма интраперитонеально). Авторы одновременно измерили количество человеческого IL-1ra, которое попало в общее кровообращение и в нескольких экспериментах продемонстрировали, что эти уровни в плазме не имели никакого эффекта на увеличение мРНК CRF в ответ на введение LPS. Поэтому, возможно, IL-1 действует в пределах мозга, стимулируя увеличение мРНК CRF в ответ на периферическое введение LPS, хотя плазменные уровни АКТГ не были измерены. Однако, действительно ли IL-1 ответственен за увеличение уровней мРНК CRF в ЦНС, пока точно не известно.
Мы также обнаружили свидетельства, указывающее на то, что TNF-alpha может действовать в пределах мозга и активизировать HPA ось в ответ на местное воспаление. Интрацеребровентрикулярное, но не внутривенное введение 5 µl антител к TNF-alpha или 1-50 µg растворимых рецепторов TNF, производят ингибирование второго пика увеличения плазменной концентрации АКТГ, произведенное внутримышечным введением скипидара (881). Поскольку увеличение плазменных уровней TNF-alpha в течение локального воспаления не было обнаружено, мы предполагали, что TNF-alpha не только действовал в пределах мозга, но и что ЦНС была главным источником TNF-alpha. Однако, мы не нашли никаких свидетельств увеличения синтеза TNF-alpha, IL-1 или IL-6 в мозге крыс.
Еще более убедительные свидетельства, что IL-1, произведенный в пределах ЦНС участвует в стимулировании секреторной активности HPA оси, были получены в исследованих нейроэндокринного ответа на стресс иммобилизации (546, 777, 778). Minami с коллегами (546) сообщили, что экспрессия мРНК IL-1beta была индуцирована в гипоталамусе крысы через 30 минут после начала стресса иммобилизации. Уровни мРНК IL-1beta достигли максимума через 60 минут и оставались увеличенными в течение 120 мин. Эти результаты особенно удивительны, поскольку авторы обнаружили мРНК IL-1beta с помощью нозерн-блоттинга, принимая во внимание, что более чувствительный метод RT-PCR потребовался, чтобы надежно обнаружить увеличение экспрессии мРНК IL-1beta в ЦНС в ответ на системное введение LPS. Тем не менее, эта группа впоследствии сообщила об увеличении биологической активности IL-1 в гипоталамусе через 30-60 минут после стресса иммобилизации и кроме того продемонстрировала, что микровведение IL-1ra (2 µg) в гипоталамус ингибирует индуцированное стрессом увеличение плазменной концентрации АКТГ на 50 % (778). С другой стороны, мы не обнаружили никакого существенного эффекта IL-1ra (100 µg интрацеребровентрикулярно) или антител к TNF-alpha на увеличние плазменной концентрации АКТГ, произведенной электрошоком у крыс (881), принимая во внимание, что другие исследователи (716) обнаружили, что дефицит IL-6 не влияет на ответ HPA оси на стресс иммобилизации у мышей. Эти данные указывают, что участие цитокинов в индуцированной психологическим / физическим стрессом активации HPA оси, вероятно ограничено специфическими цитокинами и специфическими стрессорами.
В целом, хотя имееются данные, что IL-1 может быть произведен в мозге при повреждении ЦНС, при наличии в крови серьезных уровней эндотоксинов и при остром физическом / психологическом стрессе, имеется мало данных, прямо указывающих на роль IL-1, произведенного в ЦНС, в регулировании секреторного ответа HPA оси. Прямое исследование физиологической роли цитокинов, произведеных в ЦНС, в регулировании HPA оси, нуждается в разработке генетических стратегий, которые позволят выборочно изменять синтез цитокинов в специфических регионах или у специфических типов клеток (875).
I. Местная индукция IL-1 циркулирующим IL-6
Наконец, необходимо рассмотреть возможность, что IL-1, индуцированный периферической инфекцией / воспалением может активизировать HPA ось посредством механизмов, в которых не участвует ''прямое'' взаимодействие IL-1 с любым из вышеупомянутых механизмов. Имеется ряд свидетельств, что влияние IL-1 на HPA ось в течение периферической инфекции / воспаления происходит посредством индукции высоких циркулирующих уровней IL-6 и что IL-6 фактически взаимодействует с компонентами HPA оси. Действительно, IL-1 является мощным стимулятором секреции IL-6 (470, 585, 766, 871). Исследования HPA ответа оси на вирусную инфекцию (MCMV; см. секцию IIIA3) ясно указывают, что IL-1ra ингибирует увеличение плазменных уровней кортикостерона (716). Поскольку IL-1beta не был выявлен в кровообращении, плазменные уровни IL-1beta не были увеличнены в течение MCMV инфекции и существенно увеличенные плазменные уровни IL-6 были уменьшены более чем на 75 % введением IL-1ra, авторы заключили, что IL-6 - циркулирующий медиатор действия IL-1 (716). Действительно, они показали, что IL-6-дефицитные мыши также демонстрируют заметно уменьшенный кортикостероновый ответ на MCMV (716). Как и воспаление, индуцированное скипидаром, стимулирует местное, но не системное увеличение уровней IL-1beta, IL-1 ответственен за стимулирование увеличения циркулирующих уровней IL-6 в плазме и IL-6-дефицитные мыши имеют заметно уменьшенный HPA ответ оси (см. секцию IIIC). Эти результаты говорят, что циркулирующий IL-6 может быть локальным медиатором действия увеличенных уровней IL-1 на HPA ось. Действительно, было показано, что IL-6 является медиатором множества других действий IL-1, включая ингибирование синтеза протеогликанов, индукции пролиферации тимоцитов и лихорадки (97, 150, 333, 585, 602). Поэтому, при некоторых патофизиологических обстоятельствах, IL-6 может быть главным медиатором действия IL-1.
Кажется маловероятным, что внутривенное введение экзогенного IL-1 приводит к IL-6-зависимой активации HPA оси, так как увеличение плазменой концентрации АКТГ может происходить в пределах 5-10 минут после введения IL-1. Однако, имеются свидетельства, что IL-1, введенный интраперитонеально, стимулирует секрецию АКТГ у мышей IL-6-зависимым способом (584, 640). Однако, так как при патофизиолгических состояниях более часто наблюдаются увеличенные уровни IL-6, чем IL-1, имеется значительно меньше информации относительно механизмов активации HPA оси в ответ на экзогенный IL-6, чем в ответ на экзогенный IL-1 (см. секции VA-VH). Это - по крайней мере часть причины, почему была обнаружена более слабая потенция IL-6 по сравнению с IL-1, когда эти цитокины вводились животным (66, 527, 909, 1003). Отражает ли это истинное различие в потенции этих двух цитокинов о отношении взаимодействия с компонентами HPA оси, или отражает факт, что IL-1 также стимулирует высокие циркулирующие уровни IL-6, пока не известно. Однако, ясно важно определить, являются ли механизмы, описанные выше для IL-1, также уместными для IL-6. Такие исследования могли бы использовать инфузию IL-6, чтобы создать уровни IL-6, фактически наблюдаемые в течение патологических состояний.