Поводом для перевода этой статьи стало сообщение , что Тревор Маршалл считает лакто- и бифидобактерии причиной саркоидоза. Однако, в оригинале статьи (http://autoimmunityresearch.org/transcripts/AR-Proal-Metagenome.pdf) столь категоричного заявления не содержится.
Note that the gene ACE is related to myocardial infarction, renal tubular dysgenesis, Alzheimer's, the progression of SARS, diabetes mellitus, and sarcoidosis. ACE has been shown to be down-regulated by a number of peptides created by Lactobacillus and Bifdobacteria [13], species of bacteria considered to be innocuous or ''friendly.'' ... Commensal microbes that were thought to be solely benefcial to man are now known to create metabolites that interfere with the expression of genes associated with autoimmune disease. For example, peptides from of Lactobacillus and Bifdobacteria affect expression of the ACE gene.
Из этих цитат следует, что йогуртовые бактерии уменьшают экспрессию гена АПФ, следовательно производство АПФ должно уменьшаться. Даже если предположить, что ген АПФ участвует в восприимчивости к саркоидозу, йогуртовые бактерии ослабляют условия для развития саркоидоза. Однако, в генетических исследованиях саркоидоза было показано, что полиформизмы гена АПФ хотя и приводят к межиндивидуальным различиям в уровне производства АПФ, не являются причиной саркоидоза и не влияют на на серьезность болезни. Поскольку также известно, что уровень АПФ при активной болезни высокий а в ремиссии снижается, получается, что йогурты при активном саркоидозе скорее полезны, чем вредны. Для интересующихся, ниже приведен оригинальное сообщение [13]. Авторы сообщают, что среди изученных йогуртовых бактерий, наибольшим ингибирующим потенциалом в отношении АПФ обладает штамм Bifidobacterium longum 5022.
Ramchandran L, Shah NP
Proteolytic Profiles and Angiotensin-I Converting Enzyme and alpha-Glucosidase Inhibitory Activities of Selected Lactic Acid Bacteria
This study was conducted to examine the growth, proteolytic profiles as well as angiotensin-I converting enzyme (ACE) and alpha-glucosidase (alpha-glu) inhibitory potentials of selected strains of lactic acid bacteria (LAB). Two strains each of yogurt bacteria (Streptococcus thermophilus-1275 and 285, and Lactobacillus delbrueckii ssp. bulgaricus-1092 and 1368), and probiotics (L. acidophilus-4461 and 33200, and L. casei-2607 and 15286, and 1 strain of Bifidobacterium longum 5022), were cultivated in reconstituted skim milk (RSM) at 37° C and their proteolytic profiles and ACE as well as alpha-glu inhibitory activities were determined. Among all the strains of lactic acid bacteria studied, yogurt bacteria grew very well, with the exception of L. delbrueckii ssp. bulgaricus 1368 which showed a slower growth during the initial 3 h of incubation. The growth pattern corresponded well with the decrease in pH for the organisms. All the organisms showed an increase in proteolysis with time. The variations in proteolytic capabilities translated into corresponding variations in ACE inhibitory potential of these organisms. Bifidobacterium longum 5022 showed the highest ACE inhibitory potential followed by L. delbrueckii ssp. bulgaricus 1368, L. casei 15286, S. thermophilus 1275, and L. acidophilus 4461. Organisms with high intracellular enzymatic activities grew well. Also, aminopeptidases of strains of L. acidophilus 4461 and S. thermophilus 1275 that could better utilize proline containing substrates showed enhanced ACE inhibitory potential. Lactic acid bacteria possessed the ability to inhibit alpha-glu activity, which endowed them an antidiabetic property as well.
Авторы делают еще одну важную оговорку: ''No one would argue that these species aren’t present in the human body''. Действительно, видимо никто еще не искал микроорганизмы, колонизирующие организм человека и их метаболиты в саркоидных гранулемах. Но будет ли обнаружение таких организмов доказательством их этиологической роли при саркоидозе?
Альтернативные мнения о статье и этом комментарии приветствуются и будут опубликованы.
Александр Белоусов, sarcoidosis@yandex.ru
Autoimmunity Reviews, 2009
Аутоиммуннные болезни в эру метагенома
Amy D. Proal, Paul J. Albert, Trevor G. Marshall
Georgetown University, Weill Cornell Medical College, Murdoch University
Реферат
Исследования аутоиммуннный болезней в основном направлены на характеристики идентифицированных антител. Однако, поскольку наши знания о генах, связанных с болезнями постоянно расширяется, мы понимаем, что человек должен рассматриваться как суперорганизм, в котором множество бактериальных геномов (метагеном) работает в тандеме с нашим собственным геномом. По оценке National Institutes of Health (NIH), 90 % клеток Homo sapiens имеет микробное происхождение. Некоторые из этих микроорганизмов создают метаболиты, которые влияют на экспрессию генов, связанных с аутоиммуннными болезнями. Таким образом, мы должны заново исследовать, как многочисленные микробные метаболиты влияют на транскрипцию генов человека. Мы более не можем утверждать, что антитела, произведенные при аутоиммуннных болезнях, создаются исключительно как аутоантитела к человеческой ДНК. В последнее время появляются свидетельства, что человеческая микробиота, накопленная в течение жизни и разнообразные механизмы ее персистирования могут приводить к развитию болезней. В одной из моделей, обструкция VDR, ядерного рецептора транскрипции, не позволяет иммунной системе создавать ключевые антимикробные субстанции, что позволяет микроорганизмам персистировать. Гены этих микроорганизмов неизбежно становятся толчком для прогресса болезни. Недавно было обнаружено, что усилия, направленные на уменьшение количества микробиты, влияющей на VDR у пациентов с аутоиммуннной болезнью, привело к аннулированию аутоиммуннных процессов. Поскольку в рамках проекта NIH ''Human Microbiome Project'' появляется все больше данных о человеческом метагеноме, начинает появляться новое понимание патогенеза аутоиммуннных болезней.
1. Введение
Еще десять лет назад микробиологи было твердо уверены, что большинство бактериальных разновидностей, способных к персистированию в организме человека уже идентифицированы. Однако, за последние несколько лет это мнение сильно изменилось. Прогресс генетического секвенирования показал присутствие обширной человеческой микробиоты, причем обнаружение многих организмов традиционными культуральными методами представляет значительные трудности. Ранее считалось, что Homo sapiens является продуктом одного генома. В настоящее время, человек описывается как суперорганизм, в котором совместно с геномом человека персистирует множество микробных геномов [1]. Геномы взаимодействуют, влияя на трансляцию, транскрипцию и репарацию ДНК в цитоплазме инфицированных клеток. Необходимо исследовать, как человеческие и микробные метаболиты (человеческий метаболом) изменяют экспрессию ключевых генов, связанных с развитием и прогрессом аутоиммуннных болезней.
2. Человеческая микробиота
Согласно данным NIH, всего лишь 10 % клеток, которые входят в состав организма, известного как Homo sapiens, являются человеческими клетками. Остальные 90 % клеток имеют бактериальное происхождение [2]. Таким образом, Homo sapiens может быть описан как суперорганизм, в котором сосуществуют большое количество различных организмов [3]. В человеческом организме найдены ранее неизвестные бактерии. Например, гидротермальные бактерии были найдены в тазобедренных суставах при исследовании результатов артропластики [4].
До настоящего времени, лишь небольшая часть человеческой микробиоты была генетически охарактеризована и идентифицирована, оставляя большие пробелы в нашем понимании, как она действует в состоянии здоровья и болезни. Проект NIH ''Human Microbiome Project'' использует генетическое секвенирование для создания каталога человеческого микробиома. Этот проект уже позволил охарактеризовать более чем 1,000 новых бактериальных геномов [2]. Эти генетические ''отпечатки пальца'' позволяют лучше понять, как различные бактериальные разновидности и метаболиты, которые они производят, могут взаимодействовать с человеческим геномом.
Медицина достаточно уверенно оперирует с микрофлорой, которая существуют в кишечнике и органах, находящихся в контакте с окружающей средой, например, рот, уши, нос и кожа. Однако, компоненты человеческой микробиоты также вероятно персистируют во многих других тканях, включая те, которые поражаются при аутоиммуннных болезнях [5]. Такие бактерии могут персистировать внутри клеткок иммунной системы, которые, как предполагается, доолжны уничтожать их [6] или в биопленках, в которых они защищены от иммунного ответа созданным ими полимерным матриксом [7].
Эти бактерии быстро и часто обмениваются генами с родственными разновидностями и даже с отдаленно связанными разновидностями посредством горизонтального переноса гена. Дальнейшие гомологические рекомбинации внесят дополнительную путаницу в геномную последовательность. В результате, разнообразие и изменчивость человеческой микробиоты оказались намного больше, чем ожидалось [8]. Некоторые авторы считают, что число микроорганизмов, созданных посредством генетической рекомбинации является настолько высоким, что современная концепция структуры бактериальных разновидностей может оказаться устаревший [9]. Например, исследователи European Tract Meta Initiative стремятся понять, как бактерии в кишечнике могут вносить вклад в ожирение и воспалительную болезнь кишечника. Целью проекта является только исследование связи между бактериальными генами и человеческими фенотипами. ''Нас не беспокоит, какое название будут носить эти бактерии, Enterobacter или Salmonella. Мы хотим знать, имеется ли фермент, производящий углеводы, фермент, производящий газы или фермент, деградирующий белки'' - так объясняет Francisco Guarner цель проекта [10]. Эти усилия смещают фокус усилий микробиологии с поиска единственных патогена в состоянии болезни [1]. Вместо этого, все большее количество исследователей изучает, как взаимодействующие компоненты микробиоты могут вызывать болезнь.
3. Метагеном
Поскольку в Homo sapiens персистирует так много бактерий, микробиота содержит миллионы генов по сравнению с 31,897 генов [3], которые составляют человеческий геном. Фактически, человеческий геном ненамного больше, чем геном червя C. elegans (23,399 генов) или водяного кресса (29,388) [3]. Из-за небольшого размера, сотни и даже тысячи бактериальных клеток могут существовать внутри человеческих клеток [6]. Объединенный генетический вклад этих микроорганизмов неизбежно производит бесчисленное количество метаболитов, которые не кодируются нашим собственным, относительно маленьким геномом. Это означает, что человеческий геном - лишь один из многих геномов, которые влияют на функцию Homo sapiens. В действительности, организм, который мы называем Homo sapiens управляется метагеномом, огромным числом различных геномов, работающих параллельно. Продукты бактериальных генов могут быть подобны нашим собственным. Например, метаболизм глюкозо-6-фосфатдегидрогеназы у человека и E. Coli практически идентичен [11]. Поэтому, взаимодействие между геномом E. coli и человеческим геномом, поскольку они обмениваются пищей и токсинами, увеличивает сложность транскрипции и трансляции для обоих организмов.
4. Бактерии изменяют экспрессию генов, которые влияют на прогресс аутоиммуннных болезней
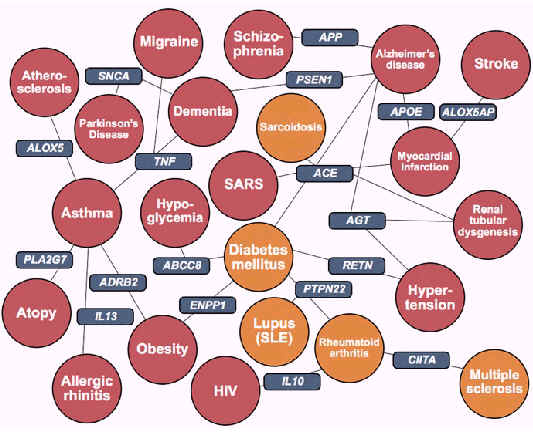
Для того, чтобы полностью понять любой процесс, связанный с суперорганизмом Homo sapiens, мы должны выяснить, как взаимодействуют бактериальные и человеческие гены. Некоторые из этих взаимодействий вносят вклад в патогенез аутоиммуннных болезней. Рис. 1 иллюстрирует некоторых из этих связей [12]. Множество аутоиммуннных и воспалительных болезней показаны вместе с генами, которые связаны с каждой из болезней.

Рис. 1. Связь между болезнями человека и генами [12]. Состояния, которые считаются аутоиммуннными, показаны оранжевым цветом. Другие воспалительные состояния показаны красным цветом.
Обратите внимание, что ген АПФ связан с инфарктом миокарда, дисгенезией почечных канальцев, болезнью Альцгеймера, прогрессом SARS (атипичной пневмонии), сахарным диабетом и саркоидозом. Было показано, что активность АПФ уменьшается множеством пептидов, производимых Lactobacillus и Bifidobacteria [13], которые обычно рассматриваются как безвредные или ''дружественные''. Хотя пока никто не доказал, что эти бактерии не существуют в человеческом организме (прим. переводчика: видимо имеется в виду обнаружение этих бактерий в пораженных вышеуказанными болезнями органах), все же имеются данные, как они влияют на хроническую воспалительную болезнь.
Например, PTPN22 связан с ревматоидным артритом, волчанкой и сахарным диабетом. Также было показано, что активность PTPN22 может быть увеличена в результате врожденного иммунного ответа на микобактерии [14]. Поскольку наша популяция стоит перед лицом вспышки латентного туберкулеза и увеличенной распространенности Mycobacterium avium, чрезвычайно важно выяснить, как увеличение активности PTPN22, вызванное латентной инфекцией или любой из микобактерий в микробиоте, может вносить вклад в аутоиммуннные процессы.
5. Капнин и персистирование метагенома
Сульфонолипид капнин, созданный бактериями, которые присутствуют в биопленках, является специфическим примером того, как бактериальные метаболиты могут управлять экспрессией человеческих генов и значительно изменять прогресс аутоиммуннных и других хронических болезней. Капнин способен нарушать транскрипцию VDR, одного из наиболее широко распространенных в организме человека ядерных рецепторов [15].
VDR экспрессируют по крайней мере 913 генов, многие из которых связаны с аутоиммуннными состояниями и злокачественными новобразованиями [16]. Этот рецептор также регулирует экспрессию нескольких антимикробных пептидов, которые играют важную роль в действиях врожденной иммунной системы против патогенов [17]. Кроме того, он участвует в транскрипции TLR2, что позволяет иммунной системе бороться с грамм-положительными бактериями [18, 19]. Таким образом, если капнин может производить дисфункцию VDR, это препятствовало бы врожденному иммунному ответу. Дисфункция VDR приводит к тому, что уровни активного метаболита витамина D 1,25-D увеличиваются до чрезмерно высоких, что может ингибировать экспрессию большую часть других ядерных рецепторов, включая рецепторы гормонов щитовидной железы, рецепторы глюкокортикоидов и рецепторы андрогенов [20]. Это может приводить к гормональным нарушениям а также влиять на экспрессию множества других антимикробных пептидов. In vivo, микробиота, возможно, постепенно блокирует врожденный иммунный ответ человека, что приводит к аккумуляции бактерий и других патогенов [21].
В конечном счете, гены микробного метагенома могут определять симптоматику клинической болезни, например аутоиммуннного состояния или просто вести к воспалению, связанному с болями при старении [5]. Аккумуляция микробного метагенома - чрезвычайно логичный эволюционный механизм. Компоненты человеческого микробиома производят дисфункцию рецептора VDR, который, в противном случае, активизировал бы мощный иммунный ответ. Как отметил Royston Goodacre в ''Journal of Nutrition'', мы рождаемся в значительной степени с человеческим геномом, который может выжить в матке и эндометрии, вдали от микробного метагенома [22]. Но мы неизбежно умираем, когда геном становится по крайней мере на 90 % бактериальным [3]. Увеличение разнообразия микробиоты в течение жизни, непосредственно коррелирует с увеличением частоты болезней, которые связаны с воспалением.
6. Антитела могут быть произведены в ответ на микробную ДНК
Аутоиммуннные болезни расцениваются как состояния, при которых иммунная система человека создает антитела против себя [23]. Теперь, когда стало понятно, что Homo sapiens является продуктом множества геномов, одинаково возможно, что антитела, наблюдаемые при аутоиммуннной болезни являются следствием изменения человеческих генов или изменения генов бактериального метагенома. Очевидно, что аутоиммуннная болезнь в значительной степени является результатом искаженного адаптивного иммунного ответа. Когда иммунная система формирует искаженный ответ на персистирующую микробиоту, она формирует каскад цитокинов и хемокинов а также стимулирует адаптивный ответ. Вероятно, в этом случае иммунная система может создавать антитела к фрагментам ДНК, которые сформировались в процессе фагоцитоза или апоптоза инфицированных клеток [5]. Однако, пока большая часть человеческой микробиоты не охарактеризована, корреляция таких антител со специфическими компонентами микробиоты остается трудной.
7. Человеческий метаболом - продукт окружающей его среды
Спектр метаболитов, обнаруженных у Homo sapiens, известен как человеческий метаболом [3]. Хотя многие бактерии производят субстраты, подобные производимым человеком, другие синтезируют метаболиты, которые значительно отличаются от побочных продуктов метаболизма человека. Человеческая микробиота у разных индивидуумов отличается, в зависимости от уникальной разновидности бактерий, накопленных в течение жизни. Это означает, что здоровье каждого человека находится под влиянием специфических метаболитов, созданных специфической микробиотой данного человека. Изменения пула метаболома - результат изменения экспрессии гена [3].
Некоторые из человеческих и микробных метаболитов в суперорганизме Homo sapiens могут быть обнаружены в образцах мочи и сыворотки. Например, масс-спектроскопия использовалась, чтобы идентифицировать не человеческие метаболиты в моче пациентов, живущих в трех различных странах - США, Китае и Японии [24]. Было обнаружно, что пациенты в каждой популяции производят значительно различающиеся не человеческие метаболиты [24]. Таким образом, факторы, связанные с персистированием специфической микробиоты (генетическая конституция, пища, развитость здравоохранения, внешние токсины), сделало различия мужду популяциями значительным. То, что факторы окружающей среды управляют метаболомом, поддержано наблюдением, что у пяти Японских пациентов, перехавших в Америку, метаболомы стали походить на метаболомы Американской популяции [24]. Таким образом ясно, что состав микробиоты Homo sapiens является гораздо более важным, чем региональные вариации непосредственно человеческого генома.
8. Микробиота может влиять на транскрипцию и трансляцию
Персистирующие бактерии, включая Francisella tularensis [25], Mycobacterium tuberculosis [26], Rickettsia massiliae [27], Brucella spp. [28], Listeria monocytogenes [29], Salmonella typhimurium [30] и другие, используют разнообразные механизмы, чтобы уклониться от действия иммунного ответа и живут внутри макрофагов и других фагоцитирующих клеток. Кроме того, различные разновидности бактерий были обнаружены внутри клеток пациентов с ювенильным ревматоидным артритом [31], саркоидозом [6] и другими воспалительными болезнями [32]. Это предполагает, что микробиота персистирует в цитоплазме клеток, имеющих ядро, где имеет доступ к транскрипции ДНК и механизму трансляции белков Homo sapiens. Например, после инфицирования макрофага, Brucella spp уменьшает экспрессию генов, участвующих в росте и метаболизме клеток, но увеличивает экспрессию генов, связанных с воспалительным ответом и системой комплемента [33]. Shingella, проживая внутри макрофага, модулирует многочисленные сигнальные пути, включая инактивацию индуцированных митогеном протеинкиназ [34]. При инфекции Mycobacterium tuberculosis, изменяется экспрессия 463 человеческих генов [35].
Микроорганизмы также способны к объединению ДНК с нашей собственной [36]. Через какое-то время это приводит к изменениям человеческой ДНК микробиотой, потенциально ведя к генетическим мутациям, связанным с аутоиммуннными болезнями. Генетические гаплотипы, наблюдаемые при аутоиммуннных болезнях статистически наблюдаются значительно реже, чем ожидалось на основании предположения, что метаболом изменяется от популяции к популяции и от индивидуума к индивидууму. Кроме того, механизмы репарации ДНК человека восприимчивы к продуктам метаболома. Фактически, бактерии могут блокировать механизм репарации ДНК, чтобы обеспечить свое генетическое разнообразие без потери геномной стабильности [37, 38]. Если степень повреждения ДНК или мутации, вызванные бактериальными метаболитами превышает способность репаративных процессов, накопление ошибок может приводить к раннему старению, апоптозу или раку [39].
9. Обсуждение
В последнее время стало очевидно, что организм Homo sapiens состоит не только из человеческого генома, а также из геномов бактерий, бактериофагов и вирусов. Следовательно, человеческий геном не должен изучаться в изоляции. Гены, которые связаны с аутоиммуннными состояниями, восприимчивы к модификации бесчисленными патогенными метаболитами. Таким образом их активность должна изучаться в тканях, в которых они экспрессированы.
Комменсалы, которые, как ранее считалось, исключительно выгодны для человека, создают метаболиты, которые влияют на экспрессию генов, связанных с аутоиммуннными болезнями. Например, пептиды Lactobacillus и Bifidobacteria влияют на экспрессию гена АПФ. Бактерии, блокирущие экспрессию гена VDR, гарантирует свое выживание, подавляя ключевые антимикробные пептиды. Персистирование этих организмов может быть причиной воспаления и производства антител, которые в настоящее время считаются причиной аутоиммуннных процессов. Различные виды патогеном, которые накапливаются в микробиоте индивидуумов, могут влиять на развитие и прогресс болезни. Когда иммунитет скомпрометирован хронической инфекцией, организм дополнительно теряет способность останавливать пролиферацию инфекционных агентов.
Пожизненный симбиоз между человеческим геномом и персистирующими компонентами бактериального метагенома не просто приводит к модификации метагенома. Это приводит к накоплению микробных метаболитов в цитоплазме инфицированных клеток, которые способны к нарушению репарации ДНК и процессов транскрипции. Таким образом генетические ненормальности, подобные наблюдаемым при аутоиммуннных болезнях, могут быть результатом активности метагенома.
Использование агонистов VDR и антибиотиков продемонстрировало способность восстановить функцию VDR и производить улучшение при разнообразных аутоиммуннных болезнях [21, 40]. Это поддерживает концепцию, в которой персистирующий патогенный компонент микробиоты накапливается внутри макрофагов и других ядерных клеток. Использование кортикостероидов замедляет способность иммунной системы установить причину хронического воспаления, которое является следствием персистирующей инфекции. Кортикостероиды могут дать лишь кратковременное улучшение.