Перевод А. Белоусов, sarcoidosis@yandex.ru
Глава 20
Лечение саркоидоза
R.P. Baughman, E.E. Lower
University of Cincinnati Medical Center, Cincinnati, OH, USA. Correspondence: R.P. Baughman, 1001 Holmes Eden Ave, Cincinnati, OH 45267-0565, USA. Fax: 1 5135585110; E-mail: bob.baughman@uc.edu
Диапазон рекомендуемых терапий при саркоидозе находится от наблюдения без лечения до комбинированной терапии цитотоксическими средствами [1]. Главная причина такого широкого спектра возможных подходов к лечению саркоидоза, заключается в вариабельности исхода болезни. Кроме того, ни одна терапия не излечивает болезнь, а скорее является средством, позволяющим контролировать симптомы. Наконец, большое влияние оказывают предпочтения врача и мнение пациента. Все эти факторы влияют на решение о начале и продолжительности терапии.
Подход к терапии при саркоидозе вращается вокруг нескольких важных проблем. Они суммированы в таблице 1. Одна из проблем касается симптомов, от которых пациент страдает. В большинстве исследований, по крайней мере третья часть больных с саркоидозом была бессимптомна, поэтому они не нуждались в лечении симптомов болезни [2-4]. В одном исследовании, треть пациентов с паренхиматозным вовлечением на рентгенограмме легких, имела улучшение рентгенографических ненормальностей в течение 6-месячного периода наблюдения [5]. Эта группа имела доброкачественную болезнь, только 20 % пациентов нуждались в системной терапии при постановке диагноза. Самый высокий процент пациентов, нуждавшихся в системной терапии при постановке диагноза (67 %), был зарегистрирован в клинике, где лечились главным образом чернокожие пациенты [6].
Таблица 1. Вопросы, на которые нужно ответить до начала лечения саркоидоза
Для бессимптомных пациентов с персистирующими паренхиматозными инфильтратами, два исследования показали, что терапия изменяет естественное течение болезни. В одном исследовании, проводилось сравнение непрерывной системной терапии в течение 18 месяцев с системной терапией, только при необходимости. В последней группе, только 6 из 31 пациента (19 %) получали кортикостероидную терапию. Несмотря на факт, что не все пациенты в контрольной группе не получали никакой терапии, пациенты контрольной группы имели более низкую жизненную емкость (ЖЕЛ) и более высокий уровень одышки через 5 лет после прекращения терапии [5]. В исследовании, которое сравнивало системные кортикостероиды в течение 3 месяцев в сопровождении ингаляционных стероидов (будесонид) в течение 15 месяцев с плацебо, Pietinalho с колл. [7] сообщили, что лечение кортикостероидами было связано со значительно более высокой диффузионной способностью и лучшим рентгенографическим паттерном, чем у пациентов, получавшим плацебо. Дополнительный анализ через 5 лет после завершения терапии показал выгоду кортикостероидной терапии в течение 18 месяцев у пациентов с паренхиматозными инфильтратами во время лечения [8]. Интересно, что авторы также сообщили, что пациенты получавшие плацебо, имели более высокую частоту ухудшения, которое требовало системной терапии в течение 5-летнего периода наблюдения.
Успех будесонида в исследовании Pietinalho с колл. [8] поднял вопрос, можно ли контролировать болезнь у пациентов с саркоидозом, используя только ингаляционную терапию. Хотя использование ингаляционного будесонида было более эффективно чем плацебо [9, 10], другие исследователи не нашли будесонид полезным при контроле легочной болезни [11]. Флутиказон не был полезен при лечении острой или хронической симптоматической болезни [12, 13]. Однако, эти средства могут быть полезны при кашле, если это является главной проблемой [12].
Местная терапия является более успешной для лечения повреждений кожи и переднего увеита. Кортикостероиды в различных формах использовались начиная с середины 1990-х [14]. Сообщалось, что такролимус является эффективной местной терапией для рефрактерной болезни кожи [15]. Болезнь глаз лечат с помощью капель и периокулярного введения кортикостероидов [16]. Однако, местная терапия может вести к осложнениям, таким как глаукома и формирование катаракты [17]. Сообщалось, что местная кортикостероидная терапия при болезни глаз задерживает разрешение легочного саркоидоза [18].
Использование системной терапии при саркоидозе обычно основано на симптомах. Абсолютными требованиями для системной терапии являются проявления, которые являются жизнеугрожающими или орган-угрожающими. В продолжительных исследованиях, анализирующих смертность при саркоидозе, наиболее обычными причинами смерти были болезнь легкого, сердца, нервной системы и печени [19-21]. В таблице 2 приведены данные о смертности в группе пациентов с саркоидозом, наблюдаемых в специализированных клиниках и центрах, сфокусированные на относительной частоте смерти, вызванной легочной, неврологической болезнью и кардиосаркоидозом [19]. Для легочной болезни, низкая величина ЖЕЛ - индикатор увеличения смертности. Лечение легочной болезни может улучшать выживаемость. Например, 3 из 9 пациентов, имевших ЖЕЛ менее 1 л, умерли из-за дыхательной недостаточности. Только 1 из 6 пациентов, у которых ЖЕЛ увеличилась при терапии до более 1 л умер; однако, 2 из 4 пациентов без улучшения ЖЕЛ умерли в течение 7-летнего периода наблюдения [19]. Последующие исследования, выполненные у пациентов с дыхательной недостаточностью, ожидавшими трансплантацию легкого, показали, что присутствие легочной гипертонии также связано с увеличенной смертностью. Увеличенное давление в правом предсердии было связано с самым плохим прогнозом [22-24].
Таблица 2. Смертность в группе пациентов с саркоидозом, наблюдаемых в течение 7 лет [19]
| Поражение органов | Число случаев, n | Случаи смерти, n (%) |
| Любое | 479 | 22 (4.6) |
| Легкое | ||
| ЖЕЛ более 1.5 л | 438 | 3 (0.68) |
| ЖЕЛ менее 1.5 л | 41 | 10 (24) |
| Сердце | 20 | 3 (15) |
| Нервная система | 54 | 4 (7.4) |
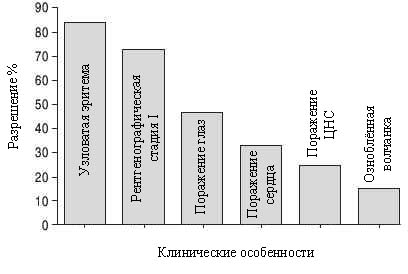
В попытке идентифицировать прогностические маркеры хронической болезни, несколько исследований предложили некоторые маркеры, связанные с разрешением болезни, и другие, связанные с длительным течением болезни. Результаты исследования Neville с колл. [25] 818 пациентов приведены на рис 1. Кроме того, почечные камни являются другим маркером хронической болезни [26]. Одним из маркером хронической болезни является увеличение числа нейтрофилов и эозинофилов в ЖБАЛ [27]. Увеличенное число нейтрофилов было связано с увеличенным уровнем интерлейкина-8 в ЖБАЛ [28]. Недавние исследования подтвердили важность этого маркера [29, 30].

Рис. 1. Частота разрешения рентгенограммы легких через 2 года у пациентов с саркоидозом с различные клиническими проявлениями [25].
Независимо от начальных проявлений, клинический результат для пациента лучше всего определяет время. Хотя рис. 1 иллюстрирует, что пациенты с узловатой эритемой и рентгенографической стадией I обычно имеют разрешение болезни в пределах 2 лет, существует подгруппа пациентов, которая даже при таких доброкачественных начальных проявлениях требует продолжительной терапии [31]. В недавнем обзоре, более 50 % пациентов наблюдаемых в течение более 5 лет после постановки диагноза, все еще нуждались в терапии. Это число включает 10 % пациентов, имевших рецидив болезни, который потребовал системной терапии в предыдущем году. Рис. 2 показывает, что существенных географических различий в частоте хронической болезни между пятью центрами не имелось [31].
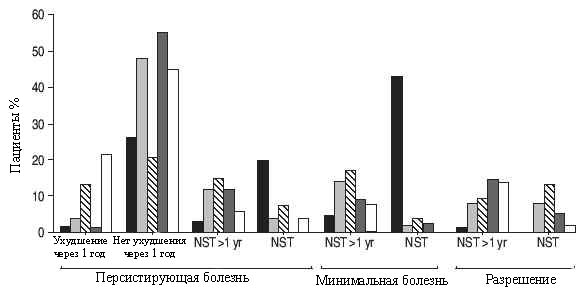
Рис. 2. Процент пациентов (n=50) в различных странах (слева направо: черный столбец: Киото (Япония); серый столбец: Mилан (Италия); заштрихованный столбец: Маастрихт (Нидерланды); черный столбец: Чарлстон (США); белый столбец: Цинциннати (США)) в каждой из основных категорий через >=5 лет после постановки диагноза. Пациенты могли иметь разрешение болезни (никаких признаков), минимальную болезнь (<10 % максимальной болезни) или персистирующую болезнь (>10 % максимальной болезни), никогда не получавшие системную терапию (NST), не получавшие системную терапию в предыдущем году (NST >1 yr) или получавшие системную терапию в прошлом году. По данным [32].
Относительные и абсолютные противопоказания существуют для всех лекарственных средств. При саркоидозе, пациенты, получавшие кортикостероиды, часто стремятся найти альтернативную терапию. Поскольку сейчас доступно большее количество лекарственных средств для лечения саркоидоза, клиницист может избежать серьезных побочных эффектов. Однако, более совершенное лекарственное средство для лечения саркоидоза должно быть найдено. В эру повышения финансовых затрат на здоровье, врачи должны рассматривать потенциальную стоимость различных средств. Кортикостероиды очень недороги, принимая во внимание, что некоторые из более новых средств, например инфликсимаб, относительно дороги.
Индивидуальные средства
Кортикостероиды
Кортикостероиды остаются стандартным лекарственным средством, с которым сравниваются все другие препараты (таблица 3). Впервые использованные для лечения саркоидоза в 1950-х [33], кортикостероиды быстро доказали, что они эффективны для лечения болезни [34]. Ранние сообщения об успехе использования кортикостероидов для лечения саркоидоза, сопровождались рядом исследований, давших отрицательный результат, когда кортикостероиды сравнивались с плацебо в рандомизированных иссследованиях [35, 36]. Другие группы обнаружили, что кортикостероиды весьма полезны при лечении хронической легочной болезни [37, 38].
Мета-анализ кортикостероидной терапии для лечения саркоидоза подтвердил ценность этой терапии [39]. Однако, этот мета-анализ также выдвинул на первый план некоторые проблемы предшествующих клинических исследований, включая исключение симптоматических пациентов и относительно короткий период наблюдения. Когда кортикостероиды использовались более 6 месяцев, кортикостероидная терапия была значительно эффективнее плацебо [40].
Наиболее спорная область использования кортикостероидной терапии - бессимптомные индивидуумы с персистирующими инфильтратами. Как было отмечено выше, имеются два исследования, демонстрирующие выгоду для пациентов с персистирующими инфильтратами, даже если они не имеют никаких симптомов. Изучились два режима: системные кортикостероиды в течение 18 месяцев [5] и системные кортикостероиды в течение 18 месяцев, сопровождаемые высокой дозировкой ингаляционного будесонида в течение 15 месяцев [8]. Однако, степень улучшения, отмеченная в конце лечения и спустя 5 лет, не имеют клинически существенных различий. Кроме того, имеется опасение, что кортикостероидная терапия может увеличивать вероятность развития хронической болезни [6], хотя это не было замечено в двух других исследованиях [5, 8]. Эти исследования позволили сформулировать рекомендацию, что бессимптомных пациентов с персистирующей болезнью не нужно лечить кортикостероидами [1].
Начальная и поддерживающая дозировка кортикостероидов в различных центрах является различной. Дозировка, необходимая для достижения ремиссии была выше, чем дозировка, необходимая для поддержания ремиссии. Judson [41] описал шесть стадий лечения саркоидоза кортикостероидами [41]. Продолжительность терапии в различных стадиях является различной. Обычно, пациенты обычно получают терапию в течение более 1 года.
Для легочной болезни, рекомендуемая начальная доза преднизона (или преднизолона) составляет 20-40 милиграмм в день [1]. Дозировка снижется за следующие 6 месяцев до менее 20 милиграмм в день. Некоторые клиницисты предпочитают использовать режим приема через день. Более высокая начальная дозировка используется для кардиосаркоидоза или неврологической болезни.
Кортикостероидная терапия не свободна от токсичности. Харви Кушинг первый описал гиперкортицизм как клиническое состояние. Фармакологические дозы глюкокортикоидов могут вести к гипергликемии, гипертонии, увеличению веса, остеопорозу, появлению угрей, глаукоме и катаракте. Рис. 4 суммирует наиболее обычные ежедневные жалобы пациентов, леченных кортикостероидами в течение 1 года. Получающие преднизон в дозировке более 10 милиграмм в день более часто сообщали о подобных жалобах [12].
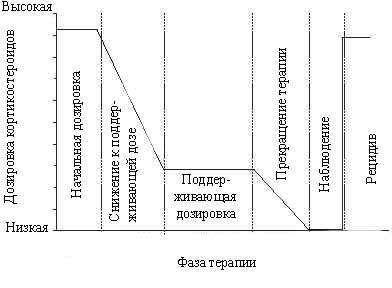
Рис. 3. Шесть стадий кортикостероидной терапии для пациентов с саркоидозом. Хотя не все пациенты имели рецидив, при рецидиве, дозировка, необходимая для лечения рецидива часто была столь же высокой, так и в начале терапии [41].
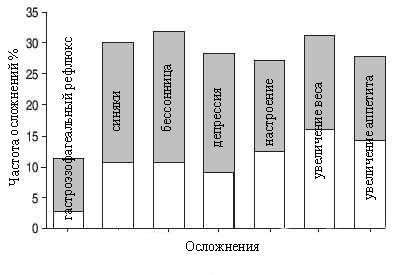
Рис. 4. Сообщения пациентов о частоте осложнений при системной кортикостероидной терапии (белый столбец: всегда; черный столбец: почти всегда) [12].
Таблица 3. Лекарственная терапия саркоидоза
| Класс | Препарат | Дозировка | Комментарий |
| Кортикостероиды | Преднизон | 5-40 милиграмм | Начальная дозировка высокая; постепенно уменьшается до минимальной, толерантной и эффективной. |
| Будесонид | 800-1600 милиграмм | Ингаляционная терапия | |
| Триамцинолон | Используется местно при болезни кожи | ||
| Цитотоксические средства | Метотрексат | 5-15 милиграмм еженедельно | Для эффективности необходима терапия в течение не менее 6 месяцев |
| Азатиоприн | 50-250 милиграмм ежедневно | Производит более серьезную лейкопению, чем метотрексат | |
| Хлорамбуцил | 2-12 милиграмм ежедневно | Больший риск злокачественных новообразований, чем у других средств | |
| Лефлуномид | 10-20 милиграмм ежедневно | Подобен метотрексату, но с меньшей тошнотой | |
| Циклофосфамид | 50-150 милиграмм перорально ежедневно или 500-2000 милиграмм внутривенно каждые 2 недели | Более высокая частота побочных эффектов, но более более высокая частота терапевтического ответа чем на другие средства | |
| Антимикробные средства | Хлорохин | 200-400 милиграмм ежедневно | |
| Гидроксихлорохин | 200-400 милиграмм ежедневно | Меньшая токсичность для глаз, чем у хлорохина | |
| Миноциклин | 100-200 милиграмм ежедневно | В редких случаях токсичен для иммунной системы | |
| Модуляция цитокинов | Пентоксифиллин | 200-400 милиграмм до 3 раз в день | Для блокирования ФНО может быть необходима высокая дозировка |
| Талидомид | 50-200 милиграмм ежедневно | Тератогенен | |
| Инфликсимаб | 5 милиграмм/кг внутривенно каждые 4-8 недель | Увеличение частоты инфекций и аллергических реакций |
Метотрексат
Антиметаболит метотрексат стал одним из стандартных средств, используемых для лечения саркоидоза [1, 42, 43]. Это стало возможно из-за его эффективности при различных проявлениях болезни, включая кожные повреждения [44, 45], легочную болезнь [42, 44], артрит [46], болезнь глаз [16, 46, 47] и неврологическую болезнь [48]. При всех этих проявлениях, метотрексат был эффективен по крайней мере у двух третей леченных пациентов.
Первое описание использования метотрексата для лечения саркоидоза было опубликовано в 1968 г. [49]. Вследствие опасения гепатотоксичности метотрексата, первоначально он использовался в течение коротких периодов, часто менее 6 месяцев. При лечении пациентов с рефрактерной болезнью метотрексатом в течение длительных периодов было продемонстрировано, что метотрексат должен использоваться по крайней мере 6 месяцев, чтобы показать объективные признаки эффективности [50]. Подобная задержка эффективности также замечена у других цитотоксических препаратов.
Токсичность метотрексата может быть разделена на острую и хроническую. Острые проблемы включают лейкопению, гастроинтестинальные симптомы и язвы слизистой. Эти побочные эффекты зависят от дозировки и часто могут быть минимизированы с помощью фолиевой кислоты. Для симптоматических пациентов или пациентов, принимающих более 10 милиграмм метотрексата в неделю, авторы обычно используют 1 милиграмм фолиевой кислоты ежедневно [51]. Леуковорин может уменьшать побочные эффекты, возникающие при использовании высоких доз метотрексата. Однако, это более дорого и обычно не является необходимым при использовании низких доз, обычно необходимых для лечения саркоидоза. Так как метотрексат задерживется почками, пациенты с существенным ухудшением почечной функции не должны получать метотрексат. Продолжительное использование метотрексата может быть связано с легочной токсичностью и гепатотоксичностью. Хотя легочная токсичность метотрексата скорее всего связана с совокупной дозой, она может быть замечена в любой момент в течение терапии [52, 53]. При лечении 209 пациентов с саркоидозом метотрексатом, у шести развился кашель, который исчез при прекращении приема метотрексата [54]. Интересно, что пациенты с кашлем при использовании метотрексата не имели кашля при лечении лефлуномидом [55].
При использовании метотрексата часто описывается гепатотоксичность. Хотя были сформулированы официальные руководящие принципы для выполнения биопсии печени у пациентов с ревматоидным артритом, у которых проводится продолжительная терапия метотрексатом [56], подобные руководящие принципы не были разработаны для пациентов с саркоидозом. В некоторых случаях проводится биопсия печени после каждого 1 г совокупно принятого метотрексата. До настоящего времени, связанная с метотрексатом гепатотоксичность была отмечена лишь при биопсии печени, но клинически существенное повреждение печени идентифицировано не было [57]. Иногда используется только серологический контроль функции печени [42].
Азатиоприн
Это цитотоксическое средство широко использовалось для лечения других интерстициальных болезней легкого, включая легочный фиброз [58]. Азатиоприн был полезен при легочном саркоидозе [59-61], однако, не все авторы сообщили о его эффективности при лечении хронической легочной болезни [62]. Главное ограничение при использовании азатиоприна - малое число исследованых пациентов. Большинство исследований включало менее 15 пациентов, за исключением одного [54], в котором 19 из 35 пациентов с саркоидозом были или устойчивы, или имели ремиссию при лечении азатиоприном. Кроме легочной болезни, сообщалось, что азатиоприн был полезен при лечении неврологической болезни [63] и болезни печени. Так как азатиоприн имеет меньшую токсичность для печени, чем метотрексат, он может быть более безопасным средством при ухудшении функции печени. Однако, сообщалось о случае серьезной гепатотоксичности азатиоприна [64].
Обычная дозировка азатиоприна составляет 2-3 милиграмма/кг. Чаще всего токсичность азатиоприна проявляется в отношении гастроинтестинального тракта. Также часто развивается лейкопения. В некоторых исследованиях эти побочные эффекты вели к прекращению приема азатиоприна у более 20 % пациентов [65]. Полиморфизм гена тиопурин-S-метилтрансферазы может предсказывать панцитопению при использовании азатиоприна, но не гастроинтестинальную токсичность [66].
Другие цитотоксические средства
Сообщалось, что другие цитотоксические средства также были выгодны при саркоидозе. Однако, опыт использования этих препаратов ограничен. В некоторых случаях, эти средства могут иметь специфическую идеальную нишу.
Лефлуномид был разработан как аналог метотрексата со значительно меньшей токсичностью [67, 68]. Легочная токсичность - редкая, но серьезная проблема метотрексата, не наблюдалась при использовании лефлуномида [55, 68]. Так как лефлуномид имеет меньшую токсичность чем метотрексат, он использовался в комбинации с метотрексатом [69]. Рандомизированное исследование показало, что эти средства действуют в синергизме при лечении ревматоидного артрита [70].
У пациентов с саркоидозом, лефлуномид был эффективен у 25 из 32 (78 %) пациентов [55]. Среди них 12 из 15 (80 %) пациентов получали комбинированную терапию метотрексатом и лефлуномидом. Лефлуномид хорошо переносился, только у 3 (9 %) пациентов лечение было прекращено из-за гастроинтестинальных симптомов.
Хлорамбуцил был эффективен у 8 из 10 пациентов с хроническим саркоидозом [71]. Однако, дополнительных выгод по сравнению с метотрексатом или азатиоприном у хлорамбуцила нет. Так как хлорамбуцил связан с увеличенным риском миелопролиферативных болезней, при саркоидозе он использовался редко.
Циклофосфамид также использовался для рефрактерного саркоидоза, особенно при неврологической болезни [48, 72, 73]. Его применение было успешным у пациентов, у которых другие терапии потерпели неудачу [48, 74]. Циклофосфамид - цитотоксическое средство, связанное с увеличенным риском злокачественных новообразований. Особенно часто это происходит, когда циклофосфамид принимается перорально по ежедневной схеме. У пациентов, леченных циклофосфамидом в течение более 1 года по ежедневной схеме, увеличен риск рака мочевого пузыря [75]. Этот риск меньше, когда используется пуль-терапия циклофосфамидом внутривенно, поэтому, это является рекомендуемым режимом при лечении нейросаркоидоза [48, 72].
Антимикробные средства
Противомалярийные средства использовались для лечения саркоидоза начиная с начала 1960-х [76, 77]. Так как эти препараты действуют как противовоспалительные средства, они также использовались для различных ревматологических состояний, таких как ревматоидный артрит и системная красная волчанка.
О выгодах гидроксихлорохина и хлорохина сообщалось при лечении кожного саркоидоза [76-78]. Эта эффективность частично была связана с большой концентрацией этих средств в кожном покрове. Кроме того, эти средства были эффективны при лечении гиперкальциемии, связанной с саркоидозом [79]. Противомалярийные средства также были эффективны в некоторых случаях нейросаркоидоза [80]. Полная эффективность противомалярийных средств при саркоидозе составляет менее 50 % [54].
Поражение глаз - главная проблема при использовании хлорохина, которая происходит намного менее часто при использовании гидроксихлорохина [81]. Отсутствие гастроинтестинальной толерантности ограничивает использование противомалярийных средств у некоторых пациентов.
Сообщалось об эффективности миноциклина и доксициклина при лечении кожного саркоидоза [82], где 8 из 12 пациентов имели полное разрешение кожных повреждений. Механизм действия этих средств остается неясным. Поскольку тетрациклины бактерицидны в отношении Propionibacterium acnes, предполагалось, что эти средства могут действовать, уничтожая предполагаемый агент саркоидоза - P. acnes [83]. Однако, другие антибиотики, такие как клиндамицин, которые также уничтожают P. acnes, не были эффективны при лечении саркоидоза. Скорее всего миноциклин и доксициклин действуют как противовоспалительные средства [84, 85], так как эти препараты были полезны при других хронических воспалительных состояниях, таких как склеродермия [86] и ревматоидный артрит [87].
Иммунномодуляторы
Имеются несколько других эффективных средств для лечения саркоидоза. Обычный механизм действия этих препаратов - влияние на иммунный ответ, особенно подавление фактора некроза опухоли (ФНО), ключевого цитокина при хроническом саркоидозе. Несколько исследований показали, что альвеолярные макрофаги пациентов с активным саркоидозом производят увеличенные уровни ФНО [88-90]. Недавние исследования продемонстрировали, что у пациентов с активной болезнью, несмотря на кортикостероидную терапию, все еще может производиться чрезмерно большое количество ФНО [91]. Это привело к использованию средств с анти-ФНО активностью [92].
Пентоксифиллин подавляет производство цитокинов альвеолярными макрофагами [93], причем при активном саркоидозе более эффективно подавляется производство ФНО, чем других цитокинов [94]. Пентоксифиллин успешно применяется при лечении острого саркоидоза [95].
Талидомид - другое средство, способное подавить производство ФНО альвеолярными макрофагами [96]. Это средство было полезным при лечении кожного саркоидоза [97-99]. Однако, в дозах, необходимых для лечения кожных повреждений, активность ФНО в кожных повреждениях не была подавлена [100]. Так как талидомид также имеет противовоспалительные и анти-ангиогенетические свойства [101], точный механизм его действия при саркоидозе остается неясным [100].
Талидомид является тератогенным. Другие побочные эффекты талидомида обычно зависят от дозы и включают сонливость, запоры, периферическую невропатию и кожные высыпания. При исследовании влияния увеличения дозировки при лечении кожного саркоидоза, 12 из 14 пациентов ответили на 100 милиграмм талидомида, принимая во внимание, что все пациенты ответили на 200 милиграмм [97]. Так как пациенты хорошо переносили 100 милиграмм талидомида, это является рекомендуемой начальной дозировкой.
С помощью методов молекулярной биологии, были разработаны биологические средства, которые блокируют ФНО. Они включают антагонисты рецепторов ФНО - этанерцепт и химерные моноклональные антитела - инфликсимаб. Эти средства эффективны при ревматоидном артрите [102, 103]. Однако, инфликсимаб [104], но не этанерцепт [105], был эффективен при лечении болезни Крона.
Инфликсимаб был выгоден при лечении рефрактерного саркоидоза [106-109]. Различные проявления болезни, включая кожные повреждения [106, 108], легочную болезнь [106], болезнь глаз [108, 110, 111] и неврологическую болезнь [107], ответили на терапию. Мультицентровое, интернациональное плацебо-управляемое исследование эффективности инфликсимаба для лечения легочного саркоидоза в настоящее время находится в стадии реализации.
Не все ингибиторы ФНО являются полезными при саркоидозе. Этанерцепт не был эффективным в большинстве случаев легочного саркоидоза [112]. В рандомизированном двойном-слепом исследовании, этанерцепт не был эффективнее плацебо при лечении хронического саркоидоза глаз [113]. Причина для различий в ответе на этанерцепт и инфликсимаб не полностью ясна. Возможное объяснение - различия в механизме действия (антагонист рецепторов против антител). Другая возможность заключается в том, что при использовании инфликсимаба, антитела к ФНО закрепляются на поверхности клеток, производящих ФНО. Это может вести к апоптозу, индуцированному инфликсимабом, но не этанерцептом [114].
Одна из наиболее серьезных проблем анти-ФНО терапии - увеличенный риск туберкулеза и других инфекций [115]. Для инфликсимаба риск выше, чем для этанерцепта. Кроме того, оба средства могут вести к аллергическим реакциям. Для этанерцепта, реакция обычно ограничивается участком подкожного введения препарата. Инфликсимаб, который используется внутривенно, может производить системные реакции, включая анафилаксию. Когда оба препарата изучались как возможная терапия для пациентов с острой сердечной недостаточностью, наблюдалось тенденция к увеличению смертности у пациентов, получавших любую анти-ФНО терапию [116, 117]. Так как период наблюдения был коротким, отдаленный риск использования этих средств остается неясным. И для этанерцепта и для инфликсимаба была предположена связь с неходжкинской лимфомой [118], но общий риск является низким и может быть связан с основной болезнью [119].
Заключение
Терапия саркоидоза стала вопросом выбора лучшего средства для конкретного пациента. Протоколы лечения больше не основаны на использовании одного препарата и включают все больше разнообразных лекарственных средств [120].
Резюме
Решение о начале лечения зависит от многих факторов, наиболее важным из которых является вопрос, действительно ли пациент является симптоматическим. Начальная системная терапия симптоматического саркоидоза обычно включает кортикостероиды. Однако, для симптоматических пациентов требуется терапия продолжительностью от нескольких месяцев до нескольких лет. Поэтому, были изучены альтернативы кортикостероидам. Они включают метотрексат и азатиоприн. Из этих двух цитотоксических средств, наиболее интенсивно был изучен метотрексат. Оба препарата работают у большинства, но не у всех пациентов. Пациенты с рефрактерным саркоидозом имеют персистирующую болезнь, несмотря на высокие дозы кортикостероидов. Средства, которые блокируют фактор некроза опухоли (ФНО), были выгодны у некоторых из этих пациентов. Талидомид был полезен при лечении рефрактерных повреждений кожи. Инфликсимаб, моноклональные антитела против ФНО, были полезны в некоторых случаях серьезной рефрактерной болезни. Из этого множества доступных средств, для лечения конкретного пациента с саркоидозом, клиницист может использовать единственное лекарственное средство или их комбинацию. Цель терапии состоит в том, чтобы минимизировать симптомы с самым низким риском для пациента.
Ключевые слова: азатиоприн, гидроксихлорохин, инфликсимаб, метотрексат, преднизон.