В переводе опущен раздел с принципами работы спектрографа и его техническими характеристиками
Journal of physiology and pharmacology 2007, 58, Suppl 5, 739.751
Спектрометрия подвижности ионов при диагностике саркоидоза: результаты предварительного исследования
M. Westhoff , P. Litterst , L. Freitag , J.I. Baumbach
Lung Hospital Hemer, Hemer, Germany; ISAS - Institute for Analytical Sciences, Department of Metabolomics, Dortmund, Germany
Реферат
Метод спектрометрии подвижности ионов (IMS) был использован, чтобы обнаружить характерные пики летучих органических компонентов в выдыхаемом воздухе объемом 10 mL, что могло бы быть полезным при диагностировании саркоидоза. Были исследованы образцы выдыхаемого воздуха у 9 пациентов с саркоидозом и с подозреваемым саркоидозом из-за увеличения средостенных лимфатических узлов. У 5 пациентов с подтвержденным саркоидозом наблюдалось высоко конгруэнтное распределение метаболитов в выдыхаемом воздухе, которое различалось по основным составляющим от пациентов с неспецифическим увеличением средостенных лимфатических узлов. Наши результаты являются первым шагом в использовании IMS у пациентов с саркоидозом.
Введение
Анализ выдыхаемого воздуха привлекает все большее внимание при диагностировании легочных болезней и оценки их активности. Поэтому, детальное изучение состава выдыхаемого воздуха у человека необходимо, чтобы выделить специфические соединения, которые можно использовать как биомаркеры. По сравнению с другими аналитическими методами, спектрометрия подвижности ионов позволяет позволяет делать эти исследования быстро. Кроме того, метод позволяет разделять летучие органические вещества в очень низких концентрациях, что характерно для воздуха, выдыхаемого человеком.
В настоящее время в мире используется более 70000 IMS устройств для обнаружения химических соединений, наркотиков и взрывчатых веществ, например в Рейхстаге и во многих аэропортах мира. Но примеров использования этого метода анализа газов в медицине мало. IMS использовался для анализа дыхания при раке легкого и инфекциях дыхательных путей (4-10).
Саркоидоз, интерстициальная болезнь легкого, вот уже много лет является диагностической и терапевтической проблемой. Было бы желательно иметь диагностический метод с высокой селективностью, который позволяет различать различные формы саркоидоза. Первые шаги в этоом направлении уже были сделаны (11).
В этом исследовании, метод спектрометрии подвижности ионов (IMS) был использован, чтобы обнаружить характерные пики летучих органических компонентов в выдыхаемом воздухе у пациентов с саркоидозом и с подозреваемым саркоидозом, чтобы обнаружить характерные летучие органические соединения. Целью исследования был анализ выдыхаемого воздуха с помощью IMS, но не идентификация большинства компонентов и их концентрации. Последние вопросы нуждаются в дальнейших исследованиях.
Пациенты
Анализ выдыхаемого воздуха с помощью IMS был выполнен у 9 пациентов: 5 пациентов имели саркоидоз, у 4 пациентов саркоидоз быть исключен гистологически.
Пациент 1: женщина, возраст 48 лет, с гистологически подтвержденным саркоидозом стадии III без дыхательной недостаточности в состоянии покоя или при физической нагрузке. Лечение артериальной гипертонии проводилось бета блокаторами.
Пациент 2: мужчина, возраст 30 лет с синдромом Лёфгрена и увеличением средостенных лимфатических узлов (диаметр 3.5 см). При лечении стероидами (преднизон, 80 милиграмм) лимфатические узлы уменьшились. Функция легкого не имела ухудшения при нагрузке мощностью 125 ватт.
Пациент 3: мужчина, возраст 50 лет с подозреваемым саркоидозом. Радиологическая картина соответствовала стадии II саркоидоза, с увеличением средостенных лимфатических узлов и небольшими легочными узелками. Анализ ЖБАЛ показал лимфоцитарный альвеолит (27 %) и отношение CD4/CD8=5. Впоследствии при биопсии легкого был подтвержден легочный саркоидоз с поражением печени (увеличенные ферменты печени) и увеличением абдоминальных лимфатических узлов.
Пациент 4: мужчина, возраст 60 лет, с увеличением средостенных лимфатических узлов, также имел ХОБЛ, болезнь коронарных артерий, диабет и почечную недостаточность с гиперурикемией. Исследования функции легкого показали рестриктивные и обструктивные нарушения с PaO2 57 mmHg и TLCO 75 %. Гистологическое исследование средостенного лимфатического узла дало неспецифические результаты.
Пациент 5: женщина, возраст 67 лет с посттуберкулезным кальцинозом в правой верхней доле и правосторонним стенозом бронхиального дерева с синдромом средней доли, ателектазом верхней доли и увеличением средостенных лимфатических узлов. КТВР показала результаты, совместимые со стадией II саркоидоза. Исследование функции легкого показало обструктивный дефект и уменьшение TLCO (63 %). Биопсия лимфатического узла показала эпителиоидные гранулемы.
Пациент 6: пациент в возрасте 52 года с опуханием нижних конечностей, кашлем и увеличеним средостенных лимфатическихо узлов. Функция легкого не нарушена. Анализ ЖБАЛ показал лимфоцитарный альвеолит и отношение CD4/CD8=8.3. Биопсия лимфатического узла показала гранулемы, эпителиоидные и гигантские клетки.
Пациент 7: пациент в возрасте 64 года, в течение 20 лет работал в угольной шахте. Острая вирусная инфекция дыхательных путей. Нарушений функции легкого нет. КТ показала увеличение средостенных лимфатических узлов. При биопсии обнаружены неспецифические воспалительные изменения в лимфатических узлах. Нормализация размера лимфатических узлов произошла при наблюдении без лечения.
Пациент 8: мужчина, возраст 65 лет с увеличенными претрахеальными лимфатическими узлами (1.6 см) на КТ. Жалоб нет. Нормальная функция легкого. При гистологическом исследовании обнаружен антракоидный фиброз и гистиоцитоз.
Пациент 9: пациент в возрасте 65 лет с продуктивным кашлем и потерей веса на 2 кг за 3 месяца. Курит 60 пачек сигарет в год. Обструктивная болезнь легкого с FEV1 65 %. Нормальный объем легкого. КТ показала увеличенные средостенные и внутригрудные лимфатические узлы. Гистологическиское исследование показало антракоз лимфатических узлов.
Результаты
Оценка IMS хроматограмм
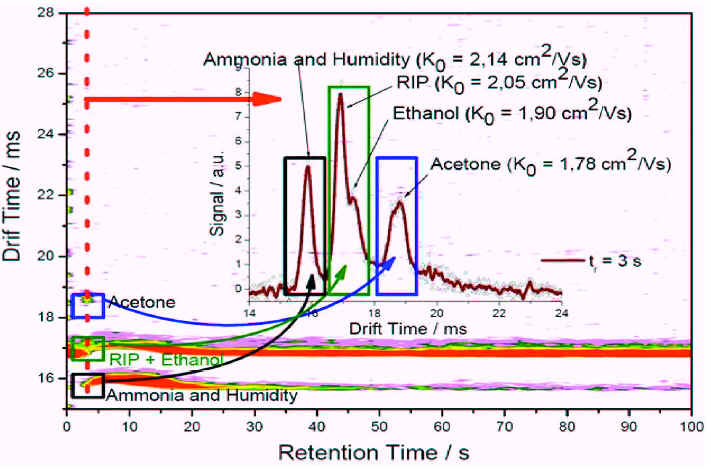
IMS хроматограммы пациентов были сравнены с IMS хроматограммами здоровых индивидуумов. На рис. 1 показана типичная IMS хроматограмма и спектр выдыхаемого воздуха с сигналами воды, аммиака и ацетона здорового человека. Небольшие изменения времени дрейфа и задержки могут происходить при изменении состояния воздуха в течение измерения например, температуры и давления, которые непосредственно влияют на подвижность ионов. Фактически, для отображения измеряемых параметов использовалось время дрейфа. Сигналы с временем задержки менее 30 с не рассматривались по методологическим причинам. Интенсивность сигнала классифицировась по 5-бальной шкале: -1 нет сигнала, 0 - шум, 1 - минимальный сигнал, 2 - хороший сигнал, 3 - интенсивный сигнал.
Рис. 1 Типичная IMS хроматограмма и спектр выдыхаемого воздуха здорового человека

Визуальный анализ IMS хроматограмм пациента 1 показал дополнительные пики в позициях 19.47 мс / 40.1 с, 20.14 мс / 47.8 с и 21.91 мс / 47.9 с (рис. 2) по сравнению со здоровыми людьми. Подобные сигналы также были замечены у пациента 2. Один из этих сигналов был также обнаружен в у пациента 3. IMS хроматограмма пациента 3 показала дополнительные пики 18 мс / 10-70 с и 20 мс / 50-100 с. У пациента 4, у которого саркоидоз был исключен, IMS не показала ни одного пика, замеченного у пациентов с саркоидозом.
Рис. 2. IMS хроматограмма пациента 1
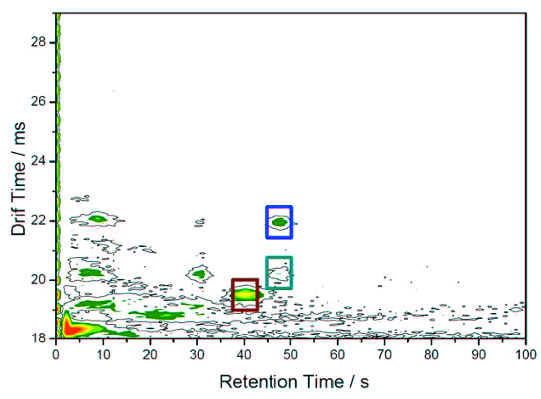
Оценка хроматограмм 5 остальных пациентов показала, что трех сигналов, обнаруженных у пациента 1 не было достаточно для визуальной дискриминации диагноза. Поэтому, из всех 9 хроматограмм для дискриминации были выбраны 13 пиков (их позиция показана крестиком на рис. 3).
Рис 3. IMS хроматограмма пациента 3
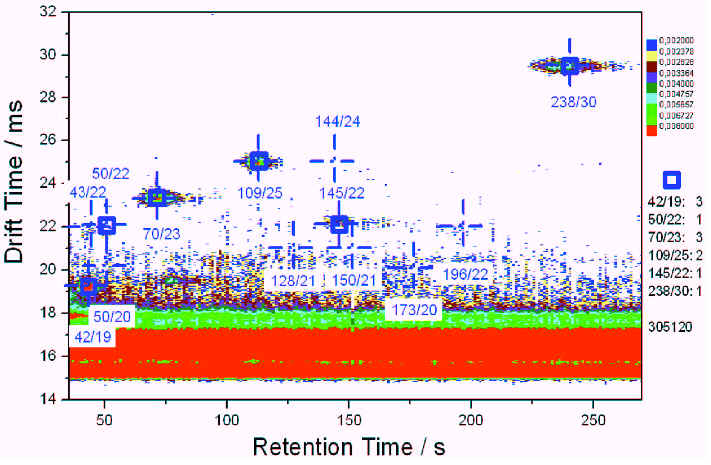
На рис 3. показана IMS хроматограмма пациента с саркоидозом, на которой присутствуют 6 сигналов из 13. Эти 6 сигналов характеризуются временем дрейфа (мс) / временем задержки (с) следующим образом: 42/19, 50/22, 70/23, 109/25, 145/22 и 238/30. Пики в 42/219 и 70/23 умели уровень 3, пик 109/25 уровень 2 и пики 50/22, 145/22 и 238/30 уровень 1. Пик 43/22 был на уровне шума, принимая во внимание, что сигналы 50/22, 128/21, 150/21, 173/20, 196/22 и 144/24 отсутствовали (уровень -1).
Присутствие или отсутствие этих сигналов было проанализировано для всех 9 пациентов аналогичным способом. Затем, используя эти данные был проведен анализ (Unscrambler O , Version 9.6, Camo, Woodbridge, USA), который позволил разделить пациентов с и без саркоидоза.
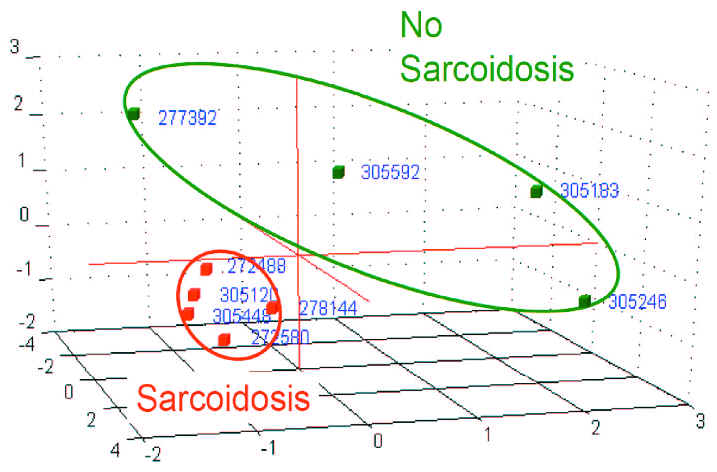
На рис. 4 показано множество, состоящее из 3 основных компонентов, которые являются близкими друг к другу для пациентов с саркоидозом, принимая во внимание, что пациенты без саркоидоза имеют переменные позиции пиков с большим рассеянием, возможно вызванным другими причинами. Исследования с большим числом пациентов вероятно позволят сделать различия между этими двумя группами более точными и определить биологическую природу пиков.
Рис 4. Результат анализа IMS хроматограмм девяти пациентов
Обсуждение
Для диагностирования и дифференцирования легочных болезней, необходимы атравматичные и высоко специфические диагностические инструменты. Диагностический потенциал анализа выдыхаемого воздуха точно не известен. Кроме того, потенциал различных методов анализа выдыхаемого воздуха должен расцениваться с учетом многих вопросов. Один из вопросов заключается в том, позволяет ли метод не только диагностировать специфическую болезнь, но может ли он определять активность болезни или прогноз. Чтобы оценить диагностическую ценность новых методов анализа выдыхаемого воздуха, полезно проверить их на здоровых людях и при болезнях, наличие которых может быть строго доказано или исключено с высокой надежностью. В отличие от методов идентификации единственного соединения или маркера, которые сначала должны быть обнаружены, выделены и проверены в отношении чувствительности и специфичности, IMS позволяет провести полную визуализацию и разделение летучих органических компонентов в выдыхаемом воздухе очень быстро.
Типичная IMS хроматограмма здорового человека показывает следующие основные компоненты выдыхаемого воздуха, аммиак (время дрейфа 16 мс), этанол (время дрейфа 17.5 мс) и ацетон (время дрейфа 18.5 мс). Замечено, что эти компоненты имеют однинаковое время задержки, то есть, им необходимо примерно одно и то же время для для прохода через мультикапиллярные колонки (multicapillary columns), но они могут быть разделены по различному времени дрейфа, то есть по различному времени пролета ионизационной камеры в электрическом поле.
Можно предположить, что у пациентов с легочными болезнями могут быть обнаружены дополнительные сигналы и патологические изменения спектрограмм. Хотя пики сигналов с различными позициями и уровнями не дают информации о химическом составе и концентрации, возможно, при что идентичных болезнях будут наблюдаться аналогичные распределения пиков, что позволит дифференцировать различные болезни по типичному паттерну пиков. До настоящего времени, IMS применялся у пациентов с инфекциями дыхательных путей и раком легкого (10, 12, 13). Было показано, что пациенты с раком легкого имели высоко специфические группы пиков, которые сильно отличаются от здоровых людей. У пациентов с инфекциями дыхательных путей, пики исчезали после терапии антибиотиками, поэтому, возможно, они были связаны с бактериями непосредственно или с метаболическими процессами, индуцированными бактериями. Исследования in vitro бактериальных культур показало типичные спектры для различных бактерий (6), которые могут быть обнаружены в IMS хроматограммах пациентов с инфекциями дыхательных путей (10).
Эти результаты показывают, что спектрометрия подвижности ионов позвляет проводить анализ выдыхаемого воздуха более чем по 1 миллиону точек и удобна для визуализации летучих органических компонентов, таким образом делая возможным обнаружение и идентификацию соединений, которые являются уместными для метаболических процессов при изучаемой болезни. Преимуществами IMS является то, что предварительная концентрация выдохнутого воздуха не является необходимой и результаты могут быть получены в пределах 15 минут, что является идеальным для клинических исследований в реальном масштабе времени.
IMS является полезным методом исследования для пациентов, у которых подозреваются болезни, которые не могут быть диагностированы с высокой уверенностью, например, саркоидоз. Имеется небольшое количество данных относительно анализа выдыхаемого воздуха у пациентов с саркоидозом, которые касаются отдельных компонентов, например NO, этана, H2O2 и 8-изопростана (14-19). Эти исследования показали, что NO не имеет диагностической ценности при саркоидозе, принимая во внимание, что H2O2 и 8-изопростан как маркеры окислительного стресса, позволяют оценить активности болезни, но не имеют диагностических преимуществ, поскольку они также увеличены при туберкулезе. Этан, маркер окисления липидов, является уместным для прогноза болезни не только при саркоидозе, но также и при других интерстициальных болезнях легкого (14). Поэтому, до настоящего времени не имеется единственного маркера или комбинации различных маркеров в выдыхаемом воздухе, которые делают возможным диагностирование саркоидоза.
Первым шагом при анализе дыхания пациентов с саркоидозом, была идентификация группы пиков в IMS хроматограммах, которые являются типичными для саркоидоза. Второй шаг, химическая идентификация летучих органических соединений, в этом исследовании не был сделан. Основной целью нашего исследования было сравнение хроматограмм пациентов с и без саркоидоза. Для этой цели, спектрограммы первых 4 пациентов интерпретировались визуально. Визуальная оценка первых 2 пациентов показала полное соответствие IMS хроматограмм по 3 пикам. Интересно, что что оба пациента имели различные клинические проявления саркоидоза. Один пациент имел стадию III саркоидоза без активной болезни, принимая во внимание, что другой пациент имел острый саркоидоз (синдром Лёфгрена). Соответствие трех пиков было поразительным, но не может быть расценено как специфическое для саркоидоза, пока большее число пациентов с саркоидозом не будет исследовано. Хотя корреляция с активностью болезни является маловероятной, она не может быть полностью исключена. Поскольку пациент 4 не имел соответствующих пиков по сравнению с первыми тремя пациентами, при визуальной интерпретацией IMS хроматограммы саркоидоз был исключен.
Трудности визуальной интерпретации IMS хроматограмм подчеркнуты данными пациента 3, который имел только один пик, который имел идентичное положении с пиками у пациента 1 и пациента 2. Очевидно, что при интерпретации IMS хроматограмм в случаях подобных пациенту 3, должны быть учтены физические явления. Обнаружение 2 довольно больших и широких пиков с временем дрейфа 18 мс и временем задержки от 10-60 с, может быть причиной отсутствия пиков с временем задержки 403 с и временем дрейфа 23 мс и может быть вызвано фактом, что формирование ионов в спектрометре является конкурентным.
Из-за различной аффинности протонов, ионы для одних соединений формируются с высокой протонной аффинностью, принимая во внимание, что для соединений с низкой аффинностью не остается достаточно реактивных ионов, способных произвести формирование пиков, соответствующих этому соединению. Измерения с различными мультикапиллярными колонками, чтобы провести лучшее предварительное разделение соединений с различным временем задержки или использование IMS с отрицательным электрическим полем возможно позволят получить лучшее дифференцирование положительных и отрицательных ионов, которые скрыты в этом широком пике. Таже может быть полезным увеличение разрешения IMS хроматограмм.
Кроме того, наше исследование показало, что при увеличении числа пациентов, распределение пиков и их интенсивность являются вариабельными и они не могут быть дифференцированы с помощью визуальной интерпретации. Причиной этого является то, что на возникновение пиков влияет не только основная болезнь, но также и сопутствующие болезни, метаболические процессы а также питание. Поэтому, визуальная интерпретация IMS хроматограмм большего числа пациентов является невозможной и необходима разработка статистического подхода для регистрации и анализа пиков, как это сделано при анализе пиков при бронхиальной карциноме (20, 21) или раке легкого (22, 23).
Хотя число пациентов в нашем исследовании было небольшим, разделение пациентов с саркоидозом от пациентов с неспецифическим увеличенеим средостенных лимфатических узлов было возможным. Как и ожидалось, пики, связанные с саркоидозом были расположены близко друг к другу, принимая во внимание, что пациенты без саркоидоза имели различные пики с большими расстояниями между ними.
Результаты нашего исследования могут быть первым шагом к разработке методики анализа выдыхаемого воздуха с помощью IMS хроматограмм при саркоидозе. Дальнешие исследования с большим числом пациентов позволит связать пики на IMS хроматограммах со специфическими химическими соединениями и получить понимание основных метаболических процессов, происходящих при саркоидозе.