Это еще одна из классических работ, посвященная одной из гипотез происхождения саркоидоза - инфекционной. Поскольку микобактерии без клеточной стенки (CWDF) были выращены исключительно из крови пациентов с саркоидозом, но не в контрольной группе, это исследование часто считается доказательством факта, что CWDF являются причиной саркоидоза. Однако, авторы, как можно заметить, крайне осторожны в своих выводах. Хотя в 2003 г. исследование, проведенное в рамках ACCESS показало, что CWDF можно с равной частотой обнаружить в крови пациентов с саркоидозом и в контрольной группе, что несколько компрометирует предыдущие сообщения, оно не отвергает возможность, что у некоторых пациентов, саркоидоз может быть связан с CWDF. Скорее всего, эта тема все еще не закрыта и нас еще ждут еще много неожиданных открытий. Более подробное освещение этого вопроса можно найти в разделе ''Гипотеза Тревора Маршалла''.
P.S. Удивительно, что в контрольную группу авторы включили только индивидуумов, не вакцинированных БЦЖ. При этом, они подчеркивают (таблица 1), что антитела к H37RV имеют максимальную реактивность к БЦЖ. Однако, были ли вакцинированы БЦЖ пациенты с саркоидозом (в том числе один пациент, у которого CWDF обнаружены не были), не сообщается. Возможно этим объясняется упомянутые выше результаты исследования ACCESS, в котором вакцинация БЦЖ не входила в критерии подбора пациентов и контрольной группы (Sheldon T. Brown at al) и уверенность Тревора Маршалла, что саркоидоз вызван Mycobacterium bovis.
Александр Белоусов, sarcoidosis@yandex.ru
Thorax 1996;51:530-533
Рост кислотоупорных L-форм из крови пациентов с саркоидозом
Peter L Almenoff, Alva Johnson, Marvin Lesser, Lida H Mattman
Department of Medicine, Veterans Affairs Medical Center, Hampton, Virginia, USA, Department of Medicine, Veterans Affai.s Medical Center, Bronx, New York, USA, Department of Medicine, Mount Sinai School of Medicine, New York, New York, USA, Department of Microbiology, Eastern Virginia Medical School, USA, Department of Biology, Wayne State University, Detroit, Michigan, USA
Реферат
Введение: мы культивировали кислотоупорные формы без клеточной стенки (CWDF) из крови, ЖБАЛ и жидкости передней камеры глаза пациентов с саркоидозом. Моноклональные антитела к H37RV использовались, чтобы охарактеризовать CWDF, выращенные из крови пациентов с саркоидозом. Методы: кровь 20 пациентов с активным саркоидозом и 20 индивидуумов контрольной группы была культивирована в условиях, благоприятных для роста CWDF. В дальнейшем изоляты были охарактеризованы с помощью непрямого флуоресцентного анализа, используя моноклональные антитела, высоко реактивные для М. tuberculosis. Результаты: CWDF были выращены из крови 19 из 20 пациентов с саркоидозом. Все изоляты окрашивались моноклональными антителами и модифицированным красителем Kinyoun. CWDF из крови контрольной группы выращены на были. Заключение: мы показали, что CWDF можно вырастать от крови почти всех пациентов с активным саркоидозом. Наши результаты подтверждают, что эти организмы имеют микобактериальное происхождение и подобны, если не идентичны, M. tuberculosis. Их роль в патогенезе саркоидоза неизвестна.
Введение
Саркоидоз - мультисистемная болезнь, характеризованная присутствием многочисленных неказеозных гранулем в пораженных органах, включая легкое, лимфатические узлы, селезенку, печень и кожу. Хотя патогенез саркоидоза остается неясным несмотря на интенсивные усилия в течение более 90 лет, некоторые результаты указывают на микобактерии, как на причинный фактор саркоидоза. Кислотоупорные организмы были обнаружены в лимфатических узлах и ткани легкого пациентов с саркоидозом (1-7), которые, возможно, являются микобактериальными формами без клеточной стенки (CWDF) (8-11). Антитела против неизвестных микобактериальных антигенов также были обнаружены в сыворотке большинства пациентов с саркоидозом (12). Увеличенное число gd T-лимфоцитов, которые пролиферируют в ответ на микобактериальные антигены, присутствуют в периферической крови пациентов с саркоидозом. Экспансия субпопуляции Vd2+ клеток наблюдается и при саркоидозе и при туберкулезе (3-16). Фрагменты микобактериальной ДНК были найдены в ЖБАЛ, ткани легкого, селезенке и лимфатических узлах пациентов с саркоидозом (17-20).
Кроме того, кислотоупорные CWDF были выращены из крови, ЖБАЛ и жидкости передней камеры глаза пациентов с саркоидозом (11, 21-24). Judge (22) и Mattman (23) культивировали CWDF у 28 из 29 пациентов с саркоидозом. Однако, в ни в одном из этих исследований не было показано, что эти организмы имели микобактериальное происхождение. В этом исследовании мы использовали моноклональные антитела к H37RV, с высокой реактивностью к M. tuberculosis (25), чтобы охарактеризовать CWDF, культивированные из крови пациентов с саркоидозом.
Пациенты
В исследование были привлечены пациенты с саркоидозом из Veterans Administration Medical Center, Hampton, Virginia. Образцы крови были взяты у пациентов с клиническим, рентгенографическим и гистологическими свидетельствами активного саркоидоза, чьи мазки и посевы были отрицательны туберкулеза (26). Все пациенты имели болезнь легкого, кроме того, три пациента имели болезнь кожи, один пациент - болезнь суставов и один - поражение ЦНС. Семь пациентов получали системные кортикостероиды. Продолжительность болезни располагалась от 0 до 8 лет. Образцы крови были также получены у здоровых индивидуумов, ни один из которых не был инфицирован ВИЧ и не имел истории туберкулеза. Все индивидуумы контрольной группы имели отрицательную туберкулиновую кожную пробу и ни один из них не был вакцинирован БЦЖ. Все участники исследования дали письменное информированное согласие. Исследование было одобрено Institutional Review Board.
Результаты
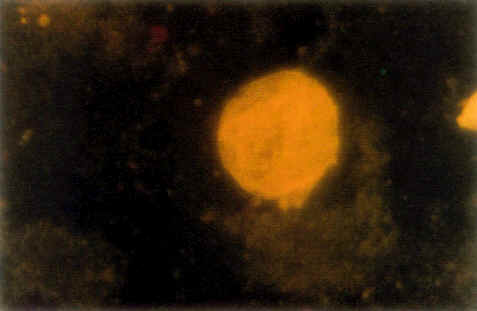
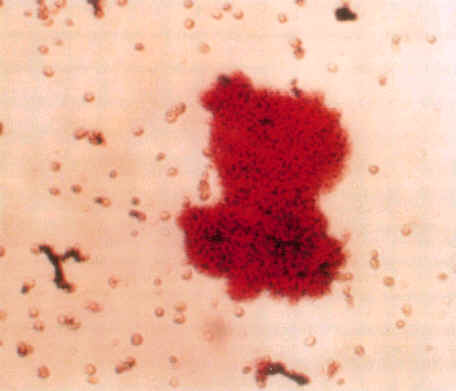
Два исследователя (AJ и LHM) выполняли непрямой флуоресцентный анализ и окрашивание по Kinyoun без информации о диагнозе пациентов. Последующая расшифровка показала, что CWDF были выращены из крови 19 из 20 (95 %) пациентов с саркоидозом. Все организмы демонстрировали реактивность к моноклональным антителам к H37RV, с формированием очевидных микроколоний (рис. 1). Все мазки также были окрашены модифицированным красителем Kinyoun (рис. 2). CWDF не были обнаружены в крови здоровой контрольной группы при окращшивании моноклональными антителами или модифицированным красителем Kinyoun.
|
|
| Рис. 1. Фотография демонстрирует CWDF, культивированные из крови пациента с активным саркоидозом, при окрашивании моноклональными антителами к H37RV. Большая желтая колония в центре и маленькие желтые микроколонии на периферии фотографии (увеличение x 400). | Рис. 2. Фотография демонстрирует CWDF, культивированные из крови пациента с активным саркоидозом, при окрашивании модифицированным красителем Kinyoun. Микроколония красного цвета в центре и красные клетки на заднем плане фотографии (увеличение x 200). |
Обсуждение
Кислотоупорные организмы были успешно культивированы из крови 19 из 20 пациентов с активным саркоидозом, принимая во внимание, что эти организмы не удалось вырастить из крови 20 индивидуумов контрольной группы. Эти организмы имели вариабельный размер, преобладающе наблюдались коккоподобные формы, большие L-формы и короткие палочковидные формы, предполагая что эти организмы были микобактериями без клеточной стенки. Ранее было показано, что эти организмы растут только в зоне, находящейся на несколько миллиметров ниже поверхности полутвердого бульона при слабо аэорфильных условиях, но неспособны размножаться в строго анаэробных условиях (23).
В отличие от CWDF из крови пациентов с туберкулезом, которые ревертируют к дикому типу in vivo (неповрежденная клеточная стенка) в присутствии антибиотиков, организмы, которые изолировали из крови пациентов с саркоидозом, не ревертируют к дикому типу при любых условиях культивирования. Наши результаты подтверждают предыдущие наблюдения, что CWDF можно вырастить из крови почти всех пациентов с саркоидозом (21, 22), эти организмы окрашиваются моноклональными антителами к H37RV, которые высоко реактивны к M. tuberculosis (25). Эти антитела слабо реактивны к микобактериям, иным чем M. tuberculosis и не реагируют с грамм-положительными и грамм-отрицательными бактериями (таблица 1). Поэтому, наши результаты подтверждают, что CWDF, изолированные у пациентов с саркоидозом, принадлежат микобактериальному семейству.
Таблица 1. Реактивность антител к H37RV к различным разновидностям микобактерий по результатам ELISA
| Антиген | Результат |
| H37RV | >2.5 |
| BCG | >2.5 |
| H37RA | 0.81 |
| M. kansasii | 0.00 |
| M. intracellulare | 0.10 |
| M. scrofulaceum | 0.07 |
| M. chelonae | 0.00 |
| M. fortuitum | 0.08 |
| M. avium | 0.11 |
| Pseudomonas aeruginosa | 0.00 |
| Escherichia coli | 0.00 |
| Klebsiella pneumoniae | 0.00 |
| Staphylococcus aureus | 0.00 |
| Streptococcus pyogenes | 0.00 |
Факт, что большинство пациентов с саркоидозом было колонизировано микобактериальными организмами не обязательно подразумевает, что этот организм является причиной болезни. Однако, Judge (22) наблюдал, что гранулематозные повреждения развивались во многих органах, включая легкое, печень, селезенку, почки и глаза у мышей и морских свинок после интраперитонеальной инстилляции CWDF, которые были выращены из крови пациентов с саркоидозом. Гистологические изменения наблюдались уже через 19 дней после введения и были более распространеными у животных, одновременно получавших кортизон. Организмы, идентичные введенным CWDF затем были выделены из крови и тканей животных. Аналогично, Barth (11) индуцировал узловые повреждения в легких мышей путем инокуляции кортизона и кислотоупорных CWDF, выделенных их жидкости передней камеры глаза пациента с саркоидозом. В обширном исследовании Mitchell (28) было показано, что хотя специфические микобактериальные организмы не были идентифицированы, гомогенаты саркоидной ткани человека введенные мышам вызывали медленное развитие диссеминированных гранулем в лимфатических узлах, легком, печени, селезенке и мышцах, которые были связаны с развитием положительной реакции Квейма. Гранулематозные изменения наблюдались у четырех последующих поколений мышей.
Напротив, другие исследователи не смогли обнаружить свидетельства участия микобактерий в этиологии саркоидоза. В нескольких исследованиях, использующих флюоресценцию, электронную микроскопию или различные культуральные методы, не было найдено никаких признаков микобактерий или фрагментов микобактериальной ДНК в гранулематозной ткани пациентов с саркоидозом (29,30). Кроме того, хотя Taub с коллегами (31) смогли стимулировать формирование гранулем у мышей при введении гомогената лимфатического узла пациента с саркоидозом, изменения были ограничены участком введения и никаких ненормальностей в лимфатических узлах, печени, селезенке или легком не развивалось и не имелось ответа на антиген Квейма. Однако, так как образцы подверглись гомогенизации до введения, рост организмов, возможно, был изменен. Интересно, что гранулемы не развивались после замораживания и размораживания гомогенатов. Ранее сообщалось, что CWDF (сферобласты) M. tuberculosis не вызывали никаких патологических изменений при интратрахеальном введении морским свинкам, даже при том, что организмы сохранялись в легких в течение длительного периода времени (32).
Недавние молекулярные исследования обнаружили связь между микобактериями и саркоидозом. Saboor с коллегами (17) обнаружили ДНК M. tuberculosis у 50 % пациентов с саркоидозом и ДНК нетуберкулезных микобактерий еще у 20 %, используя последовательность IS986/IS6110, чтобы обнаружить ДНК M. tuberculosis и последовательности микобактериального гена groEL, чтобы обнаружить ДНК микобактерий, иных чем M. tuberculosis. Частота ложноположительных реакций для M. tuberculosis в здоровой контрольной группе была 9 %. В другом исследовании, используя те же самые праймеры, авторы обнаружили ДНК M. tuberculosis в гранулематозной ткани 7 из 16 пациентов с саркоидозом (18). Mitchell с коллегами (19) используя гибридизацию с меченными зондами для рРНК M. tuberculosis complex, обнаружили, что гибридизация с тканью селезенки пациентов с саркоидозом была 4-8 раз интенсивнее, чем с тканью нормальной селезенки. Однако, Bocart (33) обнаружил ДНК M. tuberculosis в ткани только 2 из 18 пациентов с саркоидозом, используя несколько олигонуклеотидных праймеров, включая IS6110, но пациенты с доказанным туберкулезом не были включены в исследование в качестве контрольной группы. Popper с коллегами с помощью ПЦР обнаружили микобактериальную ДНК в 2 из 15 образцов ткани пациентов с саркоидозом залитых в парафине (20), принимая во внимание, что Ghossein с коллегами (34), используя аналогичные методы, не смогли обнаружить микобактериальную ДНК в образцах ткани 10 пациентов с саркоидозом.
В этом исследовании мы показали, что организмы, которые были культивированы из крови пациентов с саркоидозом имеют микобактериальное происхождение. Чтобы определить, являются ли эти организмы CWDF M. tuberculosis, близким к M. tuberculosis атипичным организмом или уникальным видом, необходимы дальнейшие исследования.