Clinical Immunology Vol. 102, No. 3, March, pp. 225–236, 2002
Связь индуцированного талидомидом дифференцирования гранулем в кожных повреждениях с улучшением саркоидоза
Stephen J. Oliver, Toyoko Kikuchi, James G. Krueger, and Gilla Kaplan
The Laboratory of Cellular Physiology and Immunology and The Laboratory of Investigative Dermatology, The Rockefeller University, New York, New York 10021
Реферат
Саркоидоз, хроническую гранулематозную болезнь неизвестной этиологии, часто лечат кортикостероидами. Пациенты с саркоидозом также имели клиническую выгоду при лечении талидомидом. Мы проводили лечение талидомидом в течение 16 недель 8 пациентов с хроническим саркоидозом кожи и оценили его эффективность. После лечения талидомидом, все биопсии кожи показали уменьшение размера гранулемы и сокращение толщины эпидермиса. Мы также наблюдали обширное привлечение T-клеток к гранулемам, многоядерные гигантские клетки и увеличенное число кожных клеток Лангерганса (CD1a+) и зрелых дендритных клеток (CD83+ или DC-LMP+). Плазменные уровни IL-12 были увеличены до начала терапии и остались увеличенные в течение терапии. Мы отметили увеличенную экспрессию HLA-DR у лимфоцитов периферической крови и передачу нативным T-клеткам маркера CD45RA. Наши данные говорят, что лечение талидомидом приводит к дифференцированию гранулем и к усилению Th1 клеточного иммунного ответа, который обычно связывают с иммунитетом к туберкулезу и туберкулоидной лепре.
Введение
Саркоидоз - мультисистемная болезнь неизвестной этиологии, характеризованная формированием неказеозных гранулем (1, 2). Хотя болезнь может быть самоограниченной, у пациентов с хронической болезнью (продолжительность более 2 лет и/или вовлечение кожи) спонтанная ремиссия происходит редко (3, 4). Для пациентов с персистирующей или серьезной симптоматической болезнью, кортикостероиды являются первичной терапией. Однако, болезнь часто прогрессирует несмотря на лечение кортикостероидами (5). Саркоидные гранулемы состоят из недифференцированных макрофагов и эпителиоидных клеток, многоядерных гигантских клеток Лангханса и преимущественно CD4+ лимфоцитов (6).
Активация клеточного иммунитета в форме увеличенной экспрессии поверхностных маркеров активации и мРНК воспалительных цитокинов замечена у макрофагов и T-клеток саркоидных гранулем а также у лейкоцитов периферической крови пациентов с саркоидозом (7-10). Наконец, CD4+ T-лимфоциты являются олигоклональными, что совместимо с процессом, управляемым антигеном (11, 12). Хотя для саркоидоза рассматриваются свидетельства в поддержку передающегося агента (13), связь между болезнью и инфекционной этиологией остается спорной.
При гранулематозных болезнях известного инфекционного происхождения, таких как туберкулез и лепра, баланс Th1/Th2 иммунного ответа против патогена, непосредственно связан с экспрессией болезни (14, 15). Th1 ответ является защитным из-за секреции IFN-gamma, который активизирует макрофаги, для более эффективного уничтожения внутриклеточных патогенов. Напротив, Th2 ответ связан с хронической и прогрессирующей болезнью, так как IL-4 и IL-10 изменяют иммунный ответ на гуморальный и подавляет клеточный ответ. При этих болезнях, сильный клеточный иммунитет связан с более хорошим клиническим результатом.
Ранее сообщалось, что талидомид был выгоден для лечения саркоидоза (16-19). Однако, механизмы, лежащие в основе эффективности талидомида у пациентов с саркоидозом не изучались. Исследователи в нашей лаборатории ранее показали, что талидомид является мощным костимулятором человеческих T-клеток in vitro (20). Используя очищенные популяции T-клеток, активизированные иммобилизированными Anti-CD3 mAb, талидомид усиливал Th1 ответ, включая пролиферацию, производство IL-2 и IFN- gamma и цитотоксический ответ. Ранее, мы обнаружили увеличенные плазменные уровни IL-12 и увеличенное ex vivo производство Th1 цитокинов у пациентов со склеродермией и ВИЧ инфекцией, леченных талидомидом (21, 22). У пациентов с ВИЧ, лечение талидомидом увеличивало антиген-специфические ответы in vitro и in vivo, включая кожные аллергические реакции (22, 23).
Таким образом, талидомид, возможно, действует как модулятор клеточного иммунитета. В 16-недельном исследовании 8 пациентов с саркоидозом с хроническим вовлечением кожи, мы показали, что их клинический ответ как в крови, так и в кожных повреждениях в течение лечения талидомидом, были связаны с усилением клеточного иммунитета, связанного с Th1 ответом.
Пациенты
Восемь ВИЧ-негативных пациентов (5 мужчин и 3 женщины), возраст от 29 до 61 года (средний возраст 34 года) с диагнозом саркоидоз, основанного на наличии неказеозных гранулем в материале биопсии, отрицательной туберкулиновой кожной пробе, отсутствии инфекционной этиологии. Информированное согласие было получено у всех пациентов. Исследование было одобрено наблюдательным советом Rockefeller University. Пациенты имели персистирующие симптомы саркоидоза в течение 4 и более лет. У всех пациентов кроме одного начальная рентгенограмма показала стадию I легочного саркоидоза (лимфаденопатия без паренхиматозных инфильтратов) и вовлечение кожи у всех пациентов. Один пациент имел стадию IV (фиброз и эмфиземы). Пациенты не получали иного лечения чем преднизон за 4 недели до начала исследования. Дозировка кортикостероидов не изменялась в течение 16-недельного исследования. Все пациенты закончили 16-недельный протокол. Пациенты нуждались в эффективной контрацепции в течение исследования. Женщины детородного возраста имели нормальные уровни человеческого хорионического бета-гонадотропина (beta HCG) в течение исследования.
Результаты
Клинические эффекты талидомида
В течение лечения талидомидом, повреждения кожи у всех пациентов стали гиперпигментированными, с уплощением повреждений у 5 из 8 пациентов. У 2 пациентов, повреждения стали гиперпигментированными, но не изменились в размере или высоте, в то время как у одного пациента, повреждения стали более рельефными и узловыми с фокальным некрозом и образованием язвы. 7 из 8 пациентов сообщили об улучшении легочных симптомов. Пациенты отметили исчезновение хронического кашля на 8 неделе терапии. Повторная рентгенограмма показала уменьшение лимфаденопатии у 5 из 8 пациентов, в то время как у 2 пациентов она осталась неизменной. У одного пациента был отмечен прогресс рентгенографических ненормальностей и рецидив кашля и одышки в течение лечения талидомидом.
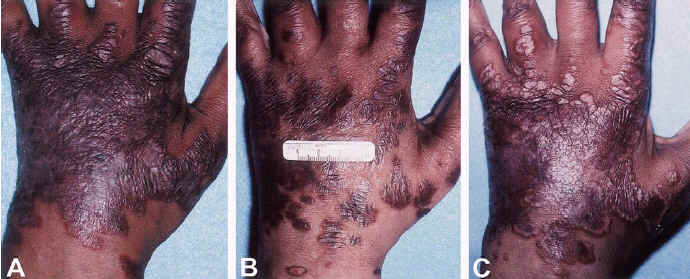
|
Клинический эффект лечения талидомидом на повреждения кожи при саркоидозе. (A) Повреждения кожи пациента до начала лечения талидомидом. (B) Через 16 недель лечения талидомидом наблюдалось уплощение и уменьшение размера повреждений. (C) Через 1 год после прекращения лечения талидомидом, размер и серьезность повреждений вернулись к уровням до начала лечения, несмотря на кортикостероидную терапию. |
Большинство пациентов отметило улучшение других симптомов болезни, одышки и конституционного недомогания. Пациенты, имевшие обильный ночной пот до начала исследования, отметили полное разрешение этого признака в пределах первого месяца лечения.
Хотя талидомид хорошо переносился в течение 4-месячного лечения, было отмечено много умеренных побочных эффектов. Переходные парестезии произошли по крайней мере однажды у 3 из 8 пациентов. Зуд и сухость кожи были отмечены у 5 из 8 пациентов, обычно в течение первого месяца лечения, продолжительностью 1 и более месяцев. Переходное воспаление повреждений кожи произошло в течение первого месяца терапии у 7 из 8 пациентов. Один пациент также имел пятнисто-папулярные эритематозные высыпания в течение второй недели лечения талидомидом. 2 пациента отметили увеличение веса в течение лечения, с возвращением к начальному весу после прекращения приема талидомида. Лабораторные параметры остались неизменными в течение лечения талидомидом, за исключением дифференциального индекса лейкоцитов крови. Наблюдалось постепенное увеличение эозинофилов (неделя 8: 294 клеток/µl, P< 0.05) в то время как индекс нейтрофилов существенно уменьшился (неделя 4: 2751 клеток/µl, начальное значение 4060 клеток/µl, P<0.005) и оставался низким в течение терапии. Увеличенная восприимчивость к инфекции не наблюдалась. Лабораторные параметры вернулись к норме после прекращения терапии талидомидом.
Иммунологические эффекты
При сравнении с группой контроля, пациенты с саркоидозом до начала лечения имели значительно увеличенные плазменные уровни TNF-alpha, IL-12, sIL-2R, IL-18 и sICAM-1 (P<0.001). Ни пациенты с саркоидозом ни группа контроля не имели обнаружимых плазменных уровней IL-4, IFN-gamma или GM-CSF. Уровни TNF-alpha и sIL-2R значительно увеличились после начала лечения талидомидом, с пиком через 2 и 4 недели, соответственно, до возвращения к начальным уровням. Уровни IL-12 значительно увеличились через 2 недели терапии и оставались увеличенными у большинства пациентов в течение терапии. Уровни IL-2, IL-10, IL-18 или sICAM-1 заметно не изменились.
Мы выполнили проточную цитометрию периферической крови до начала лечения и через 12 недель. Мы не наблюдали существенных изменений отношения CD4:CD8 или числа CD56 клеток. Мы наблюдали увеличение экспрессии MHC класса II у лимфоцитов и передачу нативным T-клеткам маркера CD45RA. У 6 из 8 пациентов была отмечена увеличенная экспрессия костимулирующих маркеров CD80 и CD86. Внутриклеточное окрашивание цитокинов было выполнено на лейкоцитах цельной крови, полученной у 4 пациентов в недели 0 и 12, стимулированных in vitro форболмиристатацетатом и иономицином. Через 12 недель лечения талидомидом, наблюдалось усиление окрашивания лимфоцитов для TNF-alpha и IL-2 у 4 из 4 пациентов и для IFN-gamma у 3 из 4 пациентов, в то время как изменений окрашивания для IL-4 и IL-10 не наблюдалось.
Гистология
Чтобы оценить эффект лечения талидомидом на повреждения кожи при саркоидозе, мы выполнили гистологическую экспертизу материалов биопсии кожи, полученных до лечения и в течение лечения. До лечения, гранулемы состояли из пенистых макрофагов, эпителиоидных клеток и рассеяных лимфоидных клеток. Было обнаружено неколько многоядерных гигантских клеток. В течение первого месяца лечения талидомидом, были отмечены изменения в кожных гранулемах. Большое число инфильтратов из лимфоидных клеток наблюдалось в кластерах макрофагов в пределах гранулем. Также наблюдалось усиление дифференцирования макрофагов в ответ на лечение талидомидом. Число пенистых макрофагов уменьшилось, клетки приобрели эпителиоидный внешний вид и наблюдалось большое число гигантских клеток. В течение недель 12-16 лечения талидомидом, эти изменения прогрессировали, с увеличенными уровнями лимфоцитов в пределах гранулем, наряду с уменьшением области клеточных инфильтратов.
Кроме того, косвенный маркер серьезности воспаления кожи - толщина эпидермиса в области повреждений, также уменьшилась при лечении талидомидом. Чтобы оценить изменения клеточного состава гранулем, мы выполнили иммуногистологическое окрашивание материалов биопсии. Число CD3+ T-лимфоцитов в пределах повреждений увеличилось при лечении талидомидом. Наблюдалось увеличение числа CD8+ T-клеток, что привело к уменьшению отношения CD4:CD8. Никакого изменения числа B-клеток не было отмечено. Число дендритных клеток (DCs) также увеличились. До начала лечения, CD1A+ незрелые DCs находились преимущественно в верхней части эпидермиса. Лечение талидомидом произвело поразительное увеличение миграции CD1A+ клеток в нижние слои эпидермиса и в дерму.
В материалах биопсии до начала лечения талидомидом наблюдалась слабая экспрессия CD83 и DC-LMP. Экспрессия этих маркеров зрелых DCs увеличилось после лечения талидомидом. Таким образом, в ответ на лечение талидомидом, мы наблюдали увеличение созревания DCs и селективное привлечение лимфоцитов к гранулемам.
Обсуждение
Мы сообщаем, что лечение талидомидом пациентов с саркоидозом привело к системной и местной иммунной активации, связанной с улучшением болезни кожи и клинических симптомов. В присутствии увеличенных плазменных уровней IL-12, мы наблюдали поразительные изменения организации и клеточного состава саркоидных гранулем в коже пациентов. Сначала наблюдалось уменьшение размера гранулемы и созревание макрофагов к эпителиоидным и многоядерным гигантским клеткам. Это сопровождалось притоком T-клеток к эпителиоидным гранулемам, что привело к уменьшению отношения CD4:CD8. Эти гистологические изменения у леченных талидомидом пациентов с саркоидозом контрастируют с результатами у пациентов с саркоидозом, леченных глюкокортикоидами, где последовательные биопсии показали быстрое уменьшение числа лимфоцитов и многоядерных гигантских клеток на участках формирования гранулем (24).
Лечение талидомидом также было связано с очевидным привлечением в кожные гранулемы CD1A+ клеток Лангерганса (незрелые DCs) и клеток, экспрессирующих DC-LMP или CD83 (зрелые DCs). Важно, что зрелые DCs и активизированные макрофаги явяются главными источниками IL-12, ключевого регулятора Th1 ответа, который стимулирует производство IFN-gamma T-клетками и естественными киллерами и увеличивает их пролиферацию и цитолитическую активность (25). Эта группа клеток (активизированные макрофаги, T-клетки и зрелые DCs) - признак защитного Th1 клеточного ответа, подобного замеченному в гранулемах при туберкулезе или туберкулоидной лепре (26, 27).
Маловероятно, что изменения в структуре гранулемы и численности популяций клеток в экземплярах биопсии наблюдались из-за естественного прогресса старых повреждений. Ранние изменения в экземплярах биопсии могли быть найдены через 2 недели лечения талидомидом. Увеличенные плазменные уровни IL-12 в течение всего периода лечения также поддерживают предположение, что изменениям в гистопатологии этих повреждений было индуцировано талидомидом. После прекращения лечения талидомидом, у всех пациентов активность болезни вернулась к уровням, наблюдавшимся до начала терапии.
Стимулирующие эффекты талидомида также наблюдались в других исследованиях (20-23, 28). И in vivo и in vitro талидомид увеличивал производство IL-12 моноцитами и стимулировал активацию Т-клеток, включая увеличение пролиферации Т-клеток и увеличение производства IL-2 и IFN-gamma Т-клетками. Также мы наблюдали индуцированное талидомидом увеличение плазменных уровней IL-12 и увеличение числа лимфоцитов, окрашиваемых для IL-2 и IFN-gamma. Эти цитокины вовлечены в Th1 иммунный ответ (29). Таким образом, наши результаты говорят, что использование талидомида при саркоидозе ведет к активации Th1 иммунного ответа. Даже у двух пациентов, которые не имели существенного клинического улучшения при лечении талидомидом, дифференцирование гранулем и увеличение плазменных уровней IL-12 и TNF-alpha также происходило.
Хотя ранее было показано, что талидомид ингибирует TNF-apha (30), важный цитокин в процессе формирования гранулемы, этот эффект талидомида не был очевиден в нашем исследовании. Это можно объяснять дифференциальным эффектом талидомида на производство цитокинов, который зависит от типа клеток и изучаемого стимула.
Талидомид ингибирует производство TNF-alpha и IL-12 макрофагами, стимулированными липополисахаридом (LPS) (31, 32), который является компонентом клеточной стенки патогена и инициирует врожденный иммунный ответ у инфицированного хозяина (33). Однако, когда использовался специфический T-клеточный стимул, чтобы активизировать PBMCs в присутствии талидомида, уровни TNF-alpha остались неизменными, в то время как уровни IL-12 увеличились, в зависимости от дозы талидомида (28). Этот эффект аннулировался блокадой CD40L (22). Дифференциальный эффект талидомида на производство фагоцитами IL-12 поддерживается сообщением о существовании двух независимых путей инициирования производства этого цитокина, прямом (LPS) или косвенном (CD40-CD40L) (34). Таким образом, ранее описанное специфическое влияние талидомида на Т-клетки in vitro, совместимы с нашими наблюдениями in vivo.
Эозинофилия, обычно связанная с Th2 ответом, наблюдалась в периферической крови пациентов в течение лечения талидомидом. Предыдущая работа показала, что талидомид увеличивает уровни GM-CSF и IL-3 и уменьшает уровни IL-5 в супернатанте PBMCs, активизированных иммобилизированными Anti-CD3 mAb (21). Изменения уровня эозинофильного колониестимулирующего фактора, как было показано только in vitro, может объяснить увеличенные индексы эозинофилов, наблюдаемые у леченных талидомидом пациентов с саркоидозом. Интересно, что гранулоцито-макрофагальный колониестимулирующий фактор (GM-CSF) и IL-3 являются важными факторами в развитии дендритных клеток (35).
Может ли усиление Th1 ответа в улучшать контроль гранулематозного воспаления при саркоидозе, даже при том, что медиаторами болезни являются Th1 цитокины? Рассмотрение болезней известной инфекционной этиологии предполагает, что усиление клеточного ответа может дать лучший контроль над гранулематозной болезнью. Сильный клеточный ответ и более эффективный контроль за Mycobacterium leprae характерны для туберкулоидной лепры, в то время как плохой прогноз связан с диссеминированной болезнью, характерной для Th2 ответа при лепроматозной лепре (36). При туберкулезе, гранулематозной болезни, связанной с сильным Th1/Th0 ответом, сильный клеточный ответ против Mycobacterium tuberculosis, связан с более эффективным контролем за проявлениями болезни (37-39). При экспериментальном туберкулезе у мышей, экзогенный IL-12 имел протективный эффект (40). Исследования у человека показали, что по сравнению со здоровой группой контроля, у пациентов с активной болезнью наблюдалось уменьшение индуцированного Mycobacterium tuberculosis производства IFN-gamma и IL-2 (39). Т-клеточная анергия присутствует у до 15 % пациентов с активным легочным туберкулезом (41). Недавнее исследование показало, что пациенты, у которых наблюдается анергия к туберкулину, также наблюдается анергия к другим антигенам. Анергия была IL-10-зависимой и сохранялась, несмотря на успешное уничтожение Mycobacteriumtuberculosis (42).
Дисфункция клеточного иммунного ответа также наблюдается у пациентов с саркоидозом. Частичная или полная кожная анергия происходит на разнообразные специфические антигены (43-47). Функциональный ответ лимфоцитов периферической крови к возбуждению in vitro, включая производство IL-2 и IFN-gamma, также нарушен (48, 49). Таким образом, при саркоидозе наблюдается хроническое воспаление вместе с дисфункцией клеточного иммунного ответа, особенности, которые являются общими с лепроматозной лепрой и активным туберкулезом и поэтому на которые можно воздействовать с помощью иммуномодуляции. Однако, при саркоидозе причина патологического ответа и оптимальный терапевтический подход остаются неизвестными. Поэтому, возможно, что в подгруппе пациентов с саркоидозом, костимуляторные эффекты талидомида могут производить эффективный клеточный иммунный ответ на неизвестный антиген.
Наша интерпретация полученных данных должна рассматриваться в контексте ограничений дизайна исследования. Поскольку 6 из 8 пациентов в исследовании оставались на постоянной терапии преднизоном с низкой дозирорвкой в течение исследования, необходимо рассматривать вопрос синергизма взаимодействия преднизона с талидомидом. Однако, подобные результаты наблюдались у пациентов, не получавших сопутствующую терапию преднизоном. Кроме того, пациенты, у которых дозировка кортикостероидов была уменьшена или их прием был прекращен после окончания исследования, при продолжении приема талидомида не имели рецидива болезни.
Наконец, так как это исследование было ограничено пациентами с кожным саркоидозом, неясно, насколько эти наблюдения можно перенести на вовлечение других органов. Это первое сообщение о влиянии талидомида на иммунный ответ при саркоидозе. Хотя клинические результаты этого исследования являются описательными и получены в течение ограниченного периода времени, результаты демонстрируют, что при лечении саркоидоза талидомидом происходит усиление клеточного ответа. Управляемые и более продолжительные исследования необходимы, чтобы определить, позволят ли иммунномодуляционные эффекты талидомида получить отдаленую клиническую выгоду у пациентов с кожным саркоидозом. Также необходимо проведение дополнительный исследований, чтобы определить механизм действия талидомида при саркоидозе и для какой подгруппы всей гетерогенной группы пациентов с саркоидозом талидомид является выгодной терапией. Крайне важным является учет серьезного тератогенного потенциала талидомида для женщин детородного возраста.

