ВЛИЯНИЕ КОМПЛЕКСНОЙ ТЕРАПИИ С ПРИМЕНЕНИЕМ АМБРОКСОЛА НА КОМПОНЕНТЫ БРОНХОАЛЬВЕОЛЯРНОГО СМЫВА У БОЛЬНЫХ САРКОИДОЗОМ ОРГАНОВ ДЫХАНИЯ
А.Д. Таганович, доктор медицинских наук, профессор; И.Л. Котович, кандидат медицинских наук, ассистент; Белорусский государственный медицинский университет
Г.Л.Бородина, кандидат медицинских наук, старший научный сотрудник; Г.Н.Семенкова, кандидат биологических наук, ассистент НИИ пульмонологии и фтизиатрии МЗ РБ
Изучено влияние амброксола на уровень фосфолипидов бронхоальвеолярной лаважной жидкости (БАЛЖ) и секрецию альвеолярными макрофагами (АМ) активных форм кислорода (АФК) и цитокинов у 9 больных саркоидозом. Группами сравнения служили 5 здоровых людей и 4 больных саркоидозом, терапия которых не включала ни амброксола, ни кортикостероидов. Через 25–28 дней от начала лечения у 77,8% больных, получавших амброксол, рентгенологически была отмечена положительная динамика патологического процесса в легких. В этот же период обнаружено усиление интенсивности люминол-зависимой хемилюминесценции АМ, выделенных из БАЛЖ больных людей, и одновременно увеличение секреции этими клетками фактора некроза опухолей-a и интерлейкина-6. Концентрация фосфолипидов в БАЛЖ у больных, получавших амброксол, также повышалась. Полученные данные свидетельствуют о целесообразности использования амброксола для патогенетического лечения саркоидоза.
До настоящего времени наиболее эффективным средством для лечения саркоидоза остаются кортикостероиды. Однако их применение из-за тяжелых побочных эффектов не всегда оправдано. Мы предположили, что включение амброксола в комплексную терапию при этом заболевании позволит эффективно влиять на патогенетические механизмы саркоидоза и избежать в ряде случаев использования кортикостероидов.
Предпосылки к настоящей работе – накопленные данные об антиоксидантных и противовоспалительных свойствах этого муколитика, его стимулирующем действии на процессы образования и секреции сурфактанта легких, влиянии на функциональную активность фагоцитов [5, 7]. В то же время хорошо известно, что непременное условие течения саркоидоза – гранулематозное воспаление в пораженной ткани, а ключевую роль в инициации и поддержании воспаления в легких при этом заболевании играют альвеолярные макрофаги (АМ). Эти клетки являются первичным защитным барьером в легких и помимо фагоцитоза выполняют ряд других функций, в том числе продуцируют активные формы кисло рода (АФК). Важнейшее значение имеет продукция активированными АМ медиаторов межклеточных взаимодействий (цитокинов), которые играют центральную роль в развитии иммунных, аллергических, воспалительных и других реакций [1]. Кроме того, АМ принимают участие в катаболизме сурфактанта легких. Хотя роль сурфактантной системы в развитии и течении саркоидоза органов дыхания окончательно не установлена, получены данные о снижении уровня фосфолипидного компонента сурфактанта в бронхоальвеолярной жидкости (БАЛЖ) больных саркоидозом [3].
В литературе отсутствовали данные о применении амброксола в качестве средства патогенетической терапии при саркоидозе органов дыхания. Поэтому нами была предпринята попытка комплексно изучить влияние этого препарата на клиническое состояние больных саркоидозом, фосфолипиды БАЛЖ, цитокин-продуцирующую способность их АМ в сопоставлении с моноцитами крови, генерацию этими клетками АФК для суждения о целесообразности применения его в курсе лечения пациентов, страдающих этим заболеванием.
Материал и методы
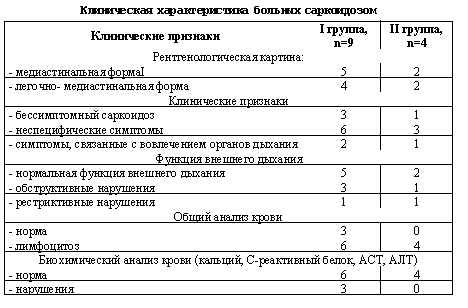
Нами были обследованы 13 пациентов с впервые выявленным саркоидозом органов дыхания (2 женщины и 11 мужчин) в возрасте 32,6±5,8 лет. Диагноз саркоидоза устанавливался на основании клинико-рентгенологической картины и был подтвержден морфологически. У 7 больных диагностирована медиастинальная форма саркоидоза, а у 6 пациентов – легочно-медиастинальная форма. Ни у одного из них не было синдрома Лефгрена (узловатая эритема, артралгия и увеличение внутригрудных узлов при рентгенографии) и внелегочных очагов саркоидоза. Контрольную группу составили 9 практически здоровых людей без признаков поражения легких. Все обследуемые больные (n=13), в зависимости от применявшейся терапии, были разделены на 2 группы. Больные, вошедшие в I группу (2 женщины и 7 мужчин в возрасте 34,6±7,1 лет), получали стандартную терапию (нестероидные противовоспалительные препараты, делагил, антиоксиданты, иммуномодуляторы, физиотерапевтичесие процедуры) и амброксол (Ambrosan, PRO. MED CS, Czech) в дозе 150 mg в день за 3 приема в течение 25 дней. Больные из II группы (4 мужчин в возрасте 27, 8±4,6 лет) получали только стандартную терапию без применения амброксола и стероидов. Клиническая характеристика обследованных больных представлена в таблице 1.

Исследование функции внешнего дыхания включало изучение следующих показателей: объема форсированного выдоха за 1 сек (ОФВ1), жизненной емкости легких (ЖЕЛ), форсированной жизненной емкости легких (ФЖЕЛ), индекса Тиффно (ОФВ1/ЖЕЛ), максимальной объемной скорости выдоха (МОС 25-75) на разных уровнях и пиковой объемной скорости выдоха (ПОС). Исследование проводилось на спирографе фирмы Erich Eger (ФРГ).
Результаты лечения были расценены как хорошие, если после курса лечения рентгенологическая картина полностью нормализовалась или значительно улучшилась (сохранились небольшие остаточные рентгенологические изменения), не выявлено нарушений функции внешнего дыхания, признаков активности внелегочных очагов саркоидоза и лабораторных критериев активности процесса. Результаты были признаны неудовлетворительными, когда после курса лечения не достигалась положительная рентгенологическая динамика процесса (сохранялась инфильтрация легочной ткани), не произошло улучшения функции внешнего дыхания, обнаруживались признаки активности внелегочных очагов саркоидоза и лабораторные критерии активности процесса. Результаты были расценены как удовлетворительные, когда после лечения у пациентов сохранялись инфильтраты в легочной ткани или положительная рентгенологическая динамика была получена только после применения кортикостероидов; функция внешнего дыхания нормализовалась или улучшилась, сохранялись минимальные лабораторные признаки активности процесса.
Бронхоальвеолярная лаважная жидкость была получена при выполнении фибробронхоскопии дважды (до лечения и через 26–28 дней после начала лечения). Обследуемые пациенты не имели других хронических заболеваний и не принимали кортикостероиды до выполнения фибробронхоскопии.
Из БАЛЖ выделяли альвеолярные макрофаги. Для этого клетки, содержащиеся в бронхоальвеолярных смывах (БАС), осаждали путем центрифугирования (200 g – 5 мин, 2–4°С). Полученный клеточный осадок ресуспендировали в культуральной среде ДМЕ (Sigma, США), 37°С, pH 7,4, содержащей 10% эмбриональной сыворотки теленка (БелНИИЭМ, Минск, Беларусь), 2 мМ L-глутамина (Sigma, США), 100 ЕД/мл пенициллина (Grunenthal, Германия) и 100 мкг/мл стрептомицина (Sigma, США). Концентрацию клеток в суспензии доводили до 1.106 жизнеспособных АМ/мл. 3 мл суспензии (3.106 АМ) вносили в пластиковые чашки Петри диаметром 3,5 см (Falcon, Англия), которые инкубировали (37°C, 5%СО2) в течение 1 ч. После этого неприлипшие клетки тщательно удаляли. Среди прилипших клеток АМ составляли >98%.
Моноциты выделяли из крови после добавления к ней 7%-го раствора декстрана и предварительного осаждения эритроцитов. Лейкоциты разделяли на фракции (200 g, 25 мин, 2–4°С) в градиенте плотности фиколла и верографина. В полученной фракции мононуклеарных клеток моноциты отделяли методом прилипания (как и АМ).
К первичной культуре АМ или моноцитов крови (МК) добавляли 3 мл свежей DME с 10% эмбриональной сыворотки. Клетки культивировали в течение 24 часов (to=37oС, увлажненная атмосфера, 5% СО2). Затем супернатант культур клеток собирали, замораживали и хранили при –70oС до определения ФНО-a и ИЛ-6 [8]. Все манипуляции при выделении культур клеток проводили с соблюдением стерильных условий.
Бесклеточную фракцию БАС концентрировали в силикагеле при 4°С, затем из нее экстрагировали липиды и определяли основные фосфолипидные компоненты легочного сурфактанта: фосфатидилхолин (ФХ) и его преобладающую форму в сурфактанте – динасыщенный фосфатидилхолин (ДНФХ); суммарную фракцию фосфатидилэтаноламина (ФЭА), включающую фосфатидилглицерол (ФГ) и минорные фракции – фосфатидилинозитол (ФИ) и фосфатидилсерин (ФС); сфингомиелин (СМ); лизофосфатидилхолин (ЛФХ). Разделение фосфолипидов (ФЛ) проводилось тонкослойной хроматографией, количественное определение – по фосфору [10].
При изучении способности АМ и МК к генерации АФК использовался метод люминол зависимой хемилюминесценции (ЛЗХЛ) [4].
Результаты обработаны общепринятыми методами вариационной статистики.
Результаты исследования
Клиническая характеристика больных после лечения амброксолом
Из 6 пациентов I группы, у которых были выявлены нарушения стандартного анализа крови в виде лимфоцитоза, у четырех больных после применения амброксола гемограмма нормализовалась, и только у 1 – лимфоцитоз сохранился, хотя степень выраженности уменьшилась. Во II группе у всех четырех пациентов умеренный лимфоцитоз продолжал регистрироваться и после курса лечения. Изменения результатов биохимических тестов в сыворотке крови в виде повышения уровня С-реактивного белка и активности аминотрансфераз обнаруживались только у трех пациентов I группы и при контрольном исследовании перестали регистрироваться. Из трех пациентов I группы, имевших нарушения функции дыхания по обструктивному типу легкой степени тяжести, у двух больных произошла нормализация показателей (МОС – 54% и 55% до лечения, 79% и 77% после лечения соответственно), а у одного (ОФВ1 – 71% до лечения, 77% – после лечения) признаки обструкции сохранились, хотя и несколько уменьшились. У единственного пациента 1 группы с наличием рестриктивных нарушений функция внешнего дыхания заметно улучшилась (ЖЕЛ – 65% до лечения и 82% после лечения). Во II группе у 1 пациента с признаками обструкции достоверных изменений функции дыхания не произошло, а у пациента с рестриктивным синдромом показатели нормализовались (ЖЕЛ – 68% до лечения и 82% после лечения).
Через 25–28 дней от начала лечения у 7 из 9 пациентов, получавших амброксол, была отмечена положительная рентгенологическая динамика, выражавшаяся в уменьшении размера внутригрудных лимфоузлов и рассасывании инфильтратов легочной ткани. Важно отметить, что исчезновение инфильтрации не сопровождалось развитием фиброзной ткани. У двух пациентов при контрольном рентгенологическом обследовании процесс остался стабильным, у 1 пациента через 1 месяц после выписки из стационара отмечено ухудшение. Во II группе положительная рентгенологическая динамика на фоне традиционной терапии получена только у 1 пациента из четырех, у одного улучшение было достигнуто только после применения в ходе дальнейшей терапии стероидов, у двух пациентов рентгенологических изменений не было выявлено.
В целом, результаты лечения расценены как хорошие у 7 пациентов I группы (77,8%) и у 1 – из II группы (25%); как удовлетворительные – у 1 пациента I группы (11,1%) и у 2 – из II группы (50%); как неудовлетворительные – у 1 пациента I группы (11,1%) и у 1 – II группы(25%).
Влияние амброксола на ЛЗХЛ АМ
На рисунке 1 представлены типичные кинетические зависимости интенсивности ЛЗХЛ, полученные при стимуляции частицами латекса, ФГА и арахидоновой кислотой суспензии свежевыделенных АМ больных саркоидозом и первичной культуры этих же клеток. Видно, что клетки образуют небольшое количество АФК, однако в суспензии свежевыделенных клеток оно всегда было выше, чем в первичной культуре. Внесение в качестве стимулятора арахидоновой кислоты в среду инкубирования клеток приводило к индуцированию ЛЗХЛ, уровень которой превышал по интенсивности в среднем на 25% ответ на латекс.
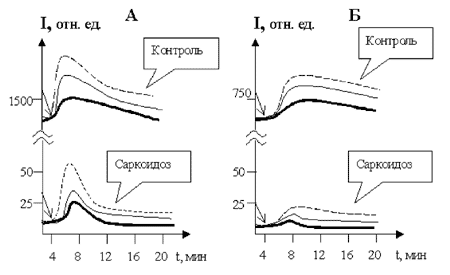

Добавление стимулирующих агентов к макрофагам больных после курса лечения с применением амброксола приводило к увеличению интенсивности и продолжительности образования АФК практически до уровня, характерного для здоровых людей. Аналогичные изменения ЛЗХЛ происходили в опытах in vitro, когда к свежевыделенным моноцитам крови больных саркоидозом в процессе развития хемилюминесцентного ответа на стимулятор добавляли амброксол (конечная концентрация 20 мкмолей), после чего продолжали измерять интенсивность ЛЗХЛ. Внесение амброксола приводило к резкому уменьшению интенсивности ЛЗХЛ (рис. 2), что согласуется с известным свойством амброксола подавлять образование активных форм кислорода.
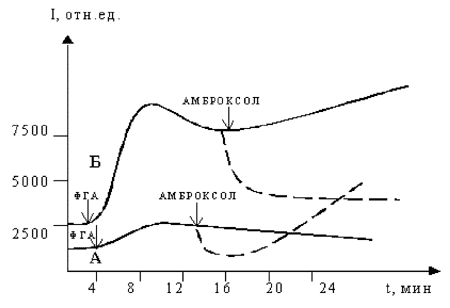

Однако в случае моноцитов, выделенных из крови больных саркоидозом, фаза «тушения» была кратковременной, в дальнейшем скорость образования АФК клетками увеличивалась. Для моноцитов здоровых людей такой эффект не выявлялся - наблюдалось стойкое подавление синтеза АФК после внесения амброксола. Данные литературы также свидетельствуют о различном действии этого препарата на мукоцилиарную систему бронхов у больных и здоровых людей [6].
Характерная двухстадийная кривая хемилюминесцентного ответа клеток на стимулятор фагоцитоза, особенно выраженная у моноцитов, обусловлена функционированием кислород-активирующих систем плазматических мембран (НАДФН-зависимый полиферментный комплекс) и включением внутриклеточной системы генерации АФК, содержащей миелопероксидазу и каталазу [2]. Очевидно, что включение амброксола в комплекс лекарственных препаратов при данном заболевании увеличивает выход АФК на первой стадии и индуцирует появление второй стадии процесса, хотя уровень кислород-активирующей способности клеток после терапии все еще ниже, чем у здоровых людей. Это свидетельствует о наличии у амброксола модулирующего влияния на клеточную активность, которое, в частности, заключается в переключении на другой путь образования АФК в фагоцитирующих клетках.
Известно, что у больных саркоидозом существенно увеличена способность к секреции цитокинов [9]. Проведенные нами эксперименты также показали, что для саркоидоза характерна повышенная спонтанная продукция этими клетками ФНО-a и ИЛ-6 по сравнению с состоянием клеточной активности у здоровых людей (табл. 2).

Интересно, что интенсивность ЛЗХЛ АМ больных саркоидозом была выше в тех случаях, когда имела место максимальная секреторная активность клеток и практически отсутствовала у макрофагов с ослабленной продукцией цитокинов. После курса противовоспалительной терапии АМ не снижали продукцию ФНО-a и ИЛ-6. У 7 из 9 обследованных больных из I группы имелась тенденция к увеличению их секреции. У одного пациента произошло резкое уменьшение продукции цитокинов (ФНО-a до лечения – 8,6 нг/мл/106, после лечения – 0,2 нг/мл/106; ИЛ-6 – 69,5 и 0,65, соответственно) с одновременным снижением жизнеспособности АМ. Спустя 1 месяц после выписки при контрольном рентгенографическом обследовании у него было обнаружено появление множества новых очагов поражения в легких. Это означает, что включение амброксола в курс проводимого лечения у больных саркоидозом оказывает нормализующее влияние на функциональную и метаболическую способность АМ.
До лечения содержание ФЭА, суммарного ФХ, ДНФХ и ОФЛ было достоверно снижено, по сравнению с контролем (табл. 3).

После терапии амброксолом количественное содержание ФЛ в БАС в среднем увеличивалось в 1,5 раза. Попарное сравнение данных (до и после лечения) позволило выявить статистически достовер ное увеличение содержания ФХ, ДНФХ и общего липидного фосфора в БАС больных. Имелась тенденция к нормализации соотношения отдельных фосфолипидных фракций. У всех пациентов, за исключением одного, у которого имелось сочетание саркоидоза с туберкулезным процессом, это сопровождалось клиническими признаками улучшения состояния (см. выше). В качестве сравнения были обследованы больные саркоидозом, в лечении которых не использовался ни амброксол, ни кортикостероиды (табл. 4).
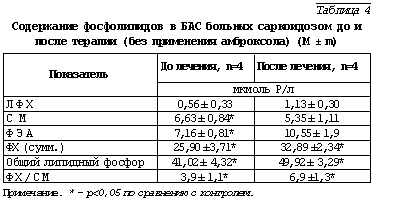
В БАС таких больных после проведенного лечения увеличилось количество ФЭА, ФХ и общего липидного фосфора, снизилось относительное содержание СМ и увеличился показатель ФХ/СМ. Однако эти изменения были менее выражены, чем при применении амброксола. Полученные данные свидетельствуют о вторичном характере изменения сурфактанта при саркоидозе, когда всякое купирование воспалительного процесса в легких или ослабление его сопровождается улучшением функционального состояния клеток и, следовательно, приводит к нормализации продуктов их метаболической активности. Тогда роль амброксола сводится к усилению выраженности этого эффекта.
Таким образом, результаты проведенного исследования показали, что после курса лечения амброксолом у больных саркоидозом сохраняется высокий уровень секреторной активности макрофагов, частично восстанавливается кислород- активирующая способность АМ и моноцитов, существенно увеличивается содержание ФЛ в БАС. Результаты клинического обследования также свидетельствуют о положительном эффекте. Однако число обследованных больных было небольшим. Поэтому приведенные результаты являются основанием для продолжения работ, которые позволят рекомендовать амброксол в качестве средства патогенетической терапии при саркоидозе.
Литература
1. Вядро М.М., Навашин С.М. Цитокины – полифункциональные регуляторы защитных реакций в норме и при патологии // Антибиотики и химиотерапия. – 1989. – Т. 34, № 11. – С. 863–873.
2. Семенкова Г.Н. Генерация активных форм кислорода при стимуляции лимфоцитов и нейтрофилов крови человека: Автореф. дисс. ... канд. биол. наук: 03.00.02. – Минск, 1989.
3. Borodina G.L., Kotovich I.L., Taganovich A.D. The abnormalities of phospholipid composition of bronchoalveolar lavage in sarcoidosis of respiratory organs // Eur. Resp. J. – 2001. – Vol. 18, suppl. 33. – P. 429s.
4. Dyke K.V., Dyke C.V., Peden D. Luminol-dependent chemiluminescence analysis of human platelets // Microchemical J. – 1980. – Vol. 25. – P. 514–523.
5. Gibbs B.F., Schmutzler W., Vollrath I.B. Ambroxol inhibits the release of histamine, leukotrienes and cytokines from human leukocytes and mast cells // Inflamm. Res. – 1999. – Vol. 48, 2. – P. 86–93.
6. Houtmeyers E., Gosselink R., Gayan-Ramirez G., Decramer M. Regulation of mucociliary clearence in health and desease // Eur. Respir. J. – 1999. – Vol. 13. – P. 1177–1188.
7. Stettner S., Ledwozyv A. The effect of ambroxol on bleomycin-induced changes in phospholipid composition of rat lung surfactant // Acta Physiol. Hung. – 1995. – Vol. 83, № 2. – P. 181–187.
8. Streiter R.M., Miller E.J., Kurdowska A.K. Measurement of cytokines in bronchoalveolar lavage fluid //Eur. Resp. J. – 1999. – Vol. 9, № 6. – P. 43–69.
9. Takizawa H., Satoh M., Oazaki H. Increased IL-6 and IL-8 in bronchoalveolar lavage fluids (BALF) from patients with sarcoidosis: correlation with clinical parameters // Clin. Exp. Immunol. – 1997. – Vol. 107, № 1. – P. 175–181.
10. Vaskovsky V.E., Kostetsky E.Y., Vasendin I.M. A universal reagent for phospholipid analysis // J. Chromatogr. – 1975. – Vol. 114. – P. 129–141.